
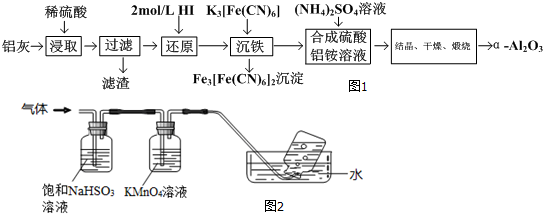
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 | I5 |
| Y | 584 | 1823 | 2751 | 11584 | 14837 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④ | B、②③ | C、①④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用待测液润洗滴定用的锥形瓶 |
| B、配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 |
| C、用稀硝酸酸洗涤盛做过银镜反应的试管 |
| D、液溴保存时液面覆盖一层水,装在带橡胶塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
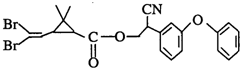 则下列对该化合物叙述正确的是( )
则下列对该化合物叙述正确的是( )| A、属于芳香烃 |
| B、属于卤代烃 |
| C、在酸性和碱性条件下都不能水解 |
| D、在一定条件下可以发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol/L H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出Na2CO3晶体 |
| C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY弱 |
| D | 先向2mL0.1mol/LNa2S溶液中滴几滴0.1mol/LZnSO4溶液,再加入几滴0.1mol/LCuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | Ksp(ZnS)<Ksp(CuS) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
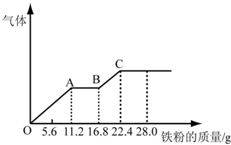 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、①③⑤ |
| C、②④ | D、③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com