
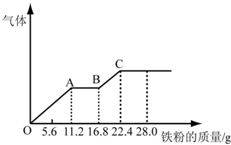
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.| m |
| M |
| 19.2g |
| 64g/mol |
| 0.3mol×2 |
| 3 |
| 11.2g |
| 56g/mol |
| 11.2g |
| 56g/mol |
| 0.2mol |
| 0.1L |
| 22.4g |
| 56g/mol |
| 0.4mol |
| 0.1L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有(1) |
| B、只有(2) |
| C、(2)(3) |
| D、(1)(2)(3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容量瓶使用前用1.0 mol?L-1的Na2CO3溶液润洗 |
| B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 |
| C、仰视确定滴定终点 |
| D、用敞开容器称量Na2CO3且时间过长 |
查看答案和解析>>
科目:高中化学 来源: 题型:
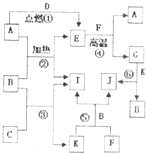 如图是中学化学常见物质之间的转换关系,其中A、C、D、F、I为单质,其余为化合物,C和D在点燃或者加热的条件下生成淡黄色的固体,B常温下为液态.试回答下列有关问题:
如图是中学化学常见物质之间的转换关系,其中A、C、D、F、I为单质,其余为化合物,C和D在点燃或者加热的条件下生成淡黄色的固体,B常温下为液态.试回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠具有很强的还原性,可用钠与TiCl4反应制取钛 |
| B、通过铝热反应可以用来焊接钢轨 |
| C、过氧化钠可以与CO2、H2O反应,可用作潜水艇供氧剂 |
| D、Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6 | B、7 | C、8 | D、9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com