
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |
| c(标)×V(标) |
| V(待) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol/L H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出Na2CO3晶体 |
| C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY弱 |
| D | 先向2mL0.1mol/LNa2S溶液中滴几滴0.1mol/LZnSO4溶液,再加入几滴0.1mol/LCuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | Ksp(ZnS)<Ksp(CuS) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示从下表中选出正确选项( )
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示从下表中选出正确选项( ) | 选项 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 石蕊 | 甲 |
| B | 酸 | 碱 | 酚酞 | 甲 |
| C | 碱 | 酸 | 甲基橙 | 乙 |
| D | 酸 | 碱 | 酚酞 | 乙 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
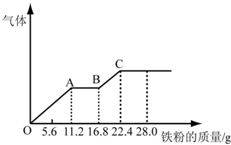 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
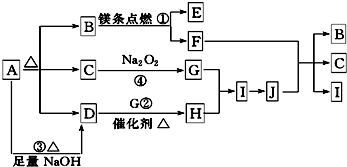
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、amol?L-元酸HA溶液与bmol?L-1NaOH溶液等体积混合后,若pH为7,则c(A-)=c(Na+) |
| B、在Kw/c(H+)=0.1mol?L-l的溶液中,Na+、K+、CO32-、NO3-能大量共存 |
| C、将等浓度等体积的Na2CO3溶液、CH3COONa溶液、NaOH溶液稀释相同倍数,pH变化最大的是CH3COONa溶液 |
| D、25℃时氢氧化钠滴定二元弱酸H2R水溶液,得到含有H2R、HR-、R2-三种微粒的溶液,当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为NaHR |
查看答案和解析>>
科目:高中化学 来源: 题型:
 盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,由如图判断下列关系错误的是( )
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,由如图判断下列关系错误的是( )| A、A→F,△H=-△H6 |
| B、△H1+△H 2+△H 3+△H 4+△H 5+△H6=1 |
| C、C→F,|△H|=|△H 1+△H 2+△H 6| |
| D、△H1+△H2+△H 3=-△H 4-△H5-△H 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com