
【题目】下列六种有机物:① 2—甲基丁烷 ② 2,2—二甲基丙烷 ③ 丙烷 ④ 戊烷 ⑤ 2—甲基丙烷 ⑥ 乙醇,按它们的沸点由高到低的顺序排列为
A、① ② ③ ④ ⑤ ⑥ B、② ③ ④ ⑤ ⑥ ①
C、④ ⑤ ⑥ ② ① ③ D、⑥ ④ ① ② ⑤ ③
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 煤的干馏和石油的分馏均属化学变化
B. 液化石油气和天然气的主要成分都是甲烷
C. 石油裂解、裂化和重整都是有机高分子生成小分子的过程
D. 煤油可由石油分馏获得,可用作燃料和保存少量金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是

①1mol该有机物可消耗3mol H2;
②不能发生银镜反应;
③分子式为C12H20O2;
④它的同分异构体中可能有酚类;
⑤1 mol该有机物水解时只能消耗1 mol NaOH
A.②③④ B.①④⑤ C.①②③ D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种有机合成中间体,Z是常见的高分子化合物,某研究小组采用如下路线合成X和Z。

已知:①化合物A的结构中有2个甲基
②RCOOR’+R’CH2COOR’ ![]()

请回答:
(1)写出化合物E的结构简式__________,F中官能团的名称是_________。
(2)Y→Z的化学方程式是____________。
(3)G→X的化学方程式是__________,反应类型是___________。
(4)若C中混有B,请用化学方法检验B的存在(要求写出操作、现象和结论)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在点燃条件下与B的单质充分反应,可以得到淡黄色固态化合物,D的M层电子数为K层电子数的3倍.试根据以上叙述回答:
(1)写出元素名称:A D ;
(2)画出D的原子结构示意图 ;
(3)用电子式表示化合物C2D的形成过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关环境问题的说法正确的是
A. 燃煤时加入适量石灰石,可减少废气中SO2的量
B. 臭氧的体积分数超过10-4%的空气有利于人体健康
C. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D. 含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:

(1) 完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +_______+H2O;双氧水的作用是____ 。
(2) 步骤②调节溶液pH,可以选用的试剂是______
A. CuO B.Fe2O3 C.Al2O3 D Cu(OH)2
(3) 有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为 、 。
(4) 将滤液B通过 、 ,过滤等操作可得到硫酸铜晶体。
(5) 测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果__ ___(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某实验小组同学进行如下实验,以检验化学反应中的能量变化,
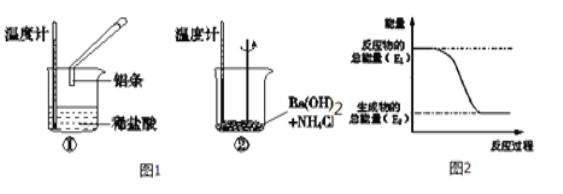
实验中发现,反应后①中的温度升高;②中的温度降低.
由此判断铝条与盐酸的反应是 热反应。
Ba(OH)28H2O与NH4Cl的反应是 热反应。
反应过程 (填“①”或“②”)的能量变化可用图2表示。.
(2)为了验证Fe3 +与Cu2+氧化性强弱,下列装置能达到实验目的的是 (填序号)。


(3)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回 答下列问题:
当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现 “节能减排” 和“低碳经济”的一项课题是如何将CO2转化为可利用资源。目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①该反应的平衡常数表达式K= ;
②从反应开始到平衡时,CH3OH的平均反应速率
v(CH3OH)= (注明单位);H2的转化率= ;
③下列说法中,能说明上述反应达到平衡状态的是
A.每消耗1mol CO2的同时生成1mol CH3OH
B.CO2、H2、CH3OH和H2O的物质的量的比为1∶3∶1∶1
C.容器中气体的压强不再改变
D.容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用高效催化剂
D.恒温恒容再充入1 molCO2和3 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com