
【题目】下列有关说法正确的是( )
A. 煤的干馏和石油的分馏均属化学变化
B. 液化石油气和天然气的主要成分都是甲烷
C. 石油裂解、裂化和重整都是有机高分子生成小分子的过程
D. 煤油可由石油分馏获得,可用作燃料和保存少量金属钠
科目:高中化学 来源: 题型:
【题目】【加试题】工业制硫酸,利用催化氧化反应将SO2转化为SO3是一个关键步骤。请回答:
(1)某温度下,SO2(g)+O2(g)![]() SO3(g) ;ΔH=-98 kJ · mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
SO3(g) ;ΔH=-98 kJ · mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
(2)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 molO2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
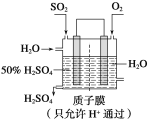
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______。
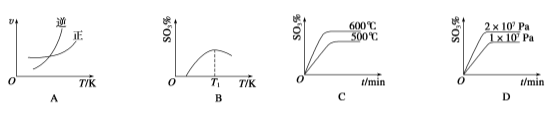
(4)下列关于2SO2(g)+O2(g)![]() 2SO3(g)反应的图像中,一定正确的是________(填序号)。
2SO3(g)反应的图像中,一定正确的是________(填序号)。
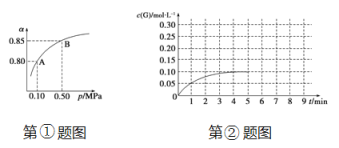
(5)①某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。当平衡状态由A变到B时,平衡常数K(A)_______ K(B)(填“>”、“<”或“=”)。
②将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度为0.25 mol·L-1)。请在下图画出此变化过程中SO3(g)浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
![]()

(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O氯化完成后过滤。

①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含的杂质,选用的试剂正确的是( )
选项 | 物质(杂质) | 试剂 |
A | Al2O3(SiO2) | NaOH溶液 |
B | FeCl2溶液(FeCl3) | Fe粉 |
C | CO2(SO2) | Na2CO3溶液 |
D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。

完成下列填空:
(1)实验时,通常加入过量的乙醇,原因是______________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________;浓硫酸用量又不能过多,原因是____________。
(2)饱和Na2CO3溶液的作用是_______________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS。某同学用15.0 g该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

回答下列问题:
(1)在下列装置中,第一次浸出必须用____________,第二次浸出应选用____________。(填标号)

(2)第二次浸出时,向盛有滤液1的反应器中加入稀硫酸,后滴入过氧化氢溶液。若顺序相反,会造成___________。滤渣2的主要成分是____________________。
(3)浓缩硫酸锌、硫酸铜溶液使用的器皿名称是________________。
(4)某同学在实验完成之后,得到1.5gCuSO4﹒5H2O,则铜的回收率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H 2 (g)=MgH 2 (s) △H 1 =-74.5kJ·mol -1
Mg 2 Ni(s) + 2H 2 (g)=Mg 2 NiH 4 (s) △H 2 =-64.4kJ·mol -1
Mg 2 Ni(s)+2MgH 2 (s) = 2Mg(s)+Mg 2 NiH 4 (s) △H 3
则△H 3 = kJ·mol -1 。
(2)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl 2 ·6H 2 O转化为MgCl 2 ·NH 4 Cl·nNH 3,然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 ;电解熔融氯化镁,阴极的电极反应式为 。
(3)储氢材料Mg(AlH4) 2 在110~200°C的反应为:Mg(AlH4) 2 =MgH 2 +2Al+3H 2 ↑每生成27gAl转移电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及MgO。实验小组设计如下流程用其制备碱式硫酸铝[Al2(OH)4SO4]:

(1)为提高“酸浸”时铝浸出率,可采取的措施之一是 。
(2)氧化时应控制反应温度在10℃~20℃,其原因是 ,“氧化”时可用MnO2替代,发生的离子方程式 。
(3)试剂X为 ,设计一个简单的实验,证明铁元素已被沉淀完全: 。
(4)加入CaCO3制备碱式硫酸铝的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列六种有机物:① 2—甲基丁烷 ② 2,2—二甲基丙烷 ③ 丙烷 ④ 戊烷 ⑤ 2—甲基丙烷 ⑥ 乙醇,按它们的沸点由高到低的顺序排列为
A、① ② ③ ④ ⑤ ⑥ B、② ③ ④ ⑤ ⑥ ①
C、④ ⑤ ⑥ ② ① ③ D、⑥ ④ ① ② ⑤ ③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com