
【题目】某地煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及MgO。实验小组设计如下流程用其制备碱式硫酸铝[Al2(OH)4SO4]:

(1)为提高“酸浸”时铝浸出率,可采取的措施之一是 。
(2)氧化时应控制反应温度在10℃~20℃,其原因是 ,“氧化”时可用MnO2替代,发生的离子方程式 。
(3)试剂X为 ,设计一个简单的实验,证明铁元素已被沉淀完全: 。
(4)加入CaCO3制备碱式硫酸铝的化学方程式 。
【答案】(1)适当加热(或将煤矸石粉碎,适当提高硫酸的浓度等)
(2)防止H2O2分解 MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2 Fe3+ + 2 H2O
(3)Al2O3;静置,取上层清液于试管中,滴加KSCN溶液,若溶液呈现血红色,说明未沉淀完全,反之则沉淀完全。
(4)Al2(SO4)3 + 2CaCO3 + 2H2O = Al2(OH)4SO4+2CaSO4+2CO2↑
【解析】
试题分析:煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及MgO,由实验流程可知,加硫酸后,Al2O3、Fe2O3、FeO、MgO均与硫酸反应,只有SiO2不反应,酸溶后溶液中含Al3+、Fe2+、Fe3+、Mg2+,然后加过氧化氢氧化Fe2+,再加X为氧化铝、氢氧化铝等调节pH,促进铁离子水解转化为沉淀,则过滤得到滤渣为SiO2、Fe(OH)3,除杂II除去溶液中镁离子,滤渣Ⅱ为Mg(OH)2,然后滤液中加硫酸酸化,再加碳酸钙调节pH,从而制备Al2(OH)4SO4,
(1)为提高“酸浸”时铝浸出率,可采取的措施之一是适当加热(或将煤矸石粉碎,适当提高硫酸的浓度等)。
故答案为:适当加热(或将煤矸石粉碎,适当提高硫酸的浓度等);
(2)氧化时应控制反应温度在10℃~20℃,其原因是防止H2O2分解,“氧化”时可用MnO2替代,发生的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O。
故答案为:防止H2O2分解;MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)试剂X为Al2O3,设计一个简单的实验,证明铁元素已被沉淀完全的方法为静置,取上层清液于试管中,滴加KSCN溶液,若溶液呈现血红色,说明未沉淀完全,反之则沉淀完全。
故答案为:Al2O3;静置,取上层清液于试管中,滴加KSCN溶液,若溶液呈现血红色,说明未沉淀完全,反之则沉淀完全;
(4)加入CaCO3制备碱式硫酸铝的化学方程式为Al2(SO4)3+2CaCO3+2H2O=Al2(OH)4SO4+2CaSO4+2CO2↑。
故答案为:Al2(SO4)3+2CaCO3+2H2O=Al2(OH)4SO4+2CaSO4+2CO2↑。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(物质结构与性质)砷的一些化合物常用作半导体、除草剂、杀鼠药等。回答下列问题:
(1)基态As原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)稼氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大至小的顺序是____________
(3) As4O6的分子结构如图所示, 其中As原子的杂化方式为_________,1 molAs406含有σ键的物质的量为___________mol 。
其中As原子的杂化方式为_________,1 molAs406含有σ键的物质的量为___________mol 。
(4)As与N是同主族元素,AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是____________
(5)H3AsO4和H3AsO3是砷的两种含氧酸,根据结构与性质的关系,H3AsO4的酸性比H3AsO3Asq 强的原因是_________________
(7)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,

其中原子坐标参数A 处Li 为(0,0,1/2);B处As为(1/4,1/4;1/4);C处Li的坐标参数为__________。
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs 单晶的晶胞参数,a ="594pm" , NA表示阿伏加德罗常数的数值,其密度为__________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 煤的干馏和石油的分馏均属化学变化
B. 液化石油气和天然气的主要成分都是甲烷
C. 石油裂解、裂化和重整都是有机高分子生成小分子的过程
D. 煤油可由石油分馏获得,可用作燃料和保存少量金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A的单质和它的一种氧化物是工业生产上常用的还原剂。B的最外层电子数是次外层的3倍;0.1molC的单质能从酸溶液中置换出2.24L标准状况下的氢气;又知B、C、D所形成的简单离子的电子层结构相同,B和E是同主族的元素。请回答下列问题:
(1)请依次写出A、C、E三种元素的元素符号: 、 、 。
(2)请写出A的最高价氧化物的电子式 ;E的单质在空气中燃烧所生成物质的化学式 。
(3)A元素可以形成多种同素异形体,其中硬度最大,不导电的是 (填物质名称);熔点高,可以导电的是 (填物质名称)。
(4)请写出C的单质与A、B形成的化合物反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含丰富的碘元素,从海带中分离出碘可按如下步骤进行:
①滴加稀硫酸酸化后,加入适量H2O2(质量分数为3%);
②将海带焙烧成灰后加水搅拌 ;
③加CCl4振荡 ;
④用分液漏斗分液;
⑤煮沸、过滤。
合理的操作顺序是( )
A.①②③④⑤ B.②⑤①③④ C.①③⑤②④ D.②①③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,满足如图所示转化关系的是

甲 | 乙 | 丙 | 戊 | |
A | Na2O2 | CO2 | O2 | Na |
B | Fe | H2O | Fe2O3 | H2 |
C | MgO | 盐酸 | MgCl2 | NaOH |
D | CuSO4 | Zn | Cu | 稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是

①1mol该有机物可消耗3mol H2;
②不能发生银镜反应;
③分子式为C12H20O2;
④它的同分异构体中可能有酚类;
⑤1 mol该有机物水解时只能消耗1 mol NaOH
A.②③④ B.①④⑤ C.①②③ D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种有机合成中间体,Z是常见的高分子化合物,某研究小组采用如下路线合成X和Z。

已知:①化合物A的结构中有2个甲基
②RCOOR’+R’CH2COOR’ ![]()

请回答:
(1)写出化合物E的结构简式__________,F中官能团的名称是_________。
(2)Y→Z的化学方程式是____________。
(3)G→X的化学方程式是__________,反应类型是___________。
(4)若C中混有B,请用化学方法检验B的存在(要求写出操作、现象和结论)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某实验小组同学进行如下实验,以检验化学反应中的能量变化,
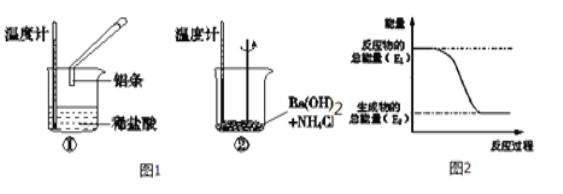
实验中发现,反应后①中的温度升高;②中的温度降低.
由此判断铝条与盐酸的反应是 热反应。
Ba(OH)28H2O与NH4Cl的反应是 热反应。
反应过程 (填“①”或“②”)的能量变化可用图2表示。.
(2)为了验证Fe3 +与Cu2+氧化性强弱,下列装置能达到实验目的的是 (填序号)。


(3)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回 答下列问题:
当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com