
【题目】【加试题】工业制硫酸,利用催化氧化反应将SO2转化为SO3是一个关键步骤。请回答:
(1)某温度下,SO2(g)+O2(g)![]() SO3(g) ;ΔH=-98 kJ · mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
SO3(g) ;ΔH=-98 kJ · mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
(2)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 molO2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
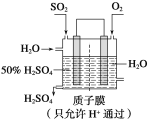
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______。
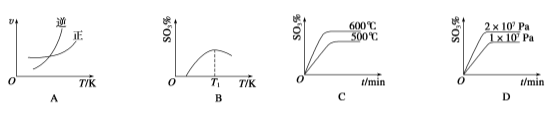
(4)下列关于2SO2(g)+O2(g)![]() 2SO3(g)反应的图像中,一定正确的是________(填序号)。
2SO3(g)反应的图像中,一定正确的是________(填序号)。
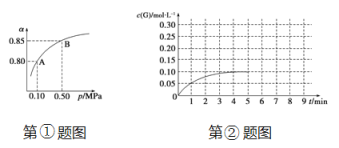
(5)①某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。当平衡状态由A变到B时,平衡常数K(A)_______ K(B)(填“>”、“<”或“=”)。
②将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度为0.25 mol·L-1)。请在下图画出此变化过程中SO3(g)浓度的变化曲线。
【答案】(1)![]() (2分)(2)ACF (2分)(3)SO2+2H2O-2e-=SO42-+4H+(2分) (4) ABD(2分)
(2分)(2)ACF (2分)(3)SO2+2H2O-2e-=SO42-+4H+(2分) (4) ABD(2分)
(5) ① =(1分) ②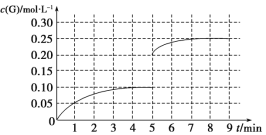 (1分)
(1分)
【解析】
试题分析:(1)反应达到平衡时共放出196kJ的热量,根据热化学方程式可知反应了2.0mol SO2和1.0mol O2,则
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始浓度(molL1) 0.04 0.1 0
转化浓度(molL1) 0.02 0.01 0.02
平衡浓度(molL1) 0.02 0.09 0.02
该温度下的平衡常数K=![]() 。
。
(2)A、保持温度和容器体积不变,充入2molSO3,平衡向逆反应方向移动,则SO2、O2、SO3气体平衡浓度都比原来增大,A正确;B、保持温度和容器体积不变,充入2molN2,对平衡移动没有影响,各物质的浓度不变,B错误;C、保持温度和容器体积不变,充入0.5 mol SO2和0.25 molO2,平衡向正反应方向进行,再次平衡后各物质的浓度均增大,C正确;D、保持温度和容器内压强不变,充入1molSO3,处于等效平衡状态,浓度不变,D错误;E、升高温度,平衡向逆反应方向移动,SO3的浓度减小,E错误;F、移动活塞压缩气体浓度均增大,F正确,答案选ACF。
(3)依据图中所示装置,二氧化硫失电子发生氧化反应,在水溶液中转化为硫酸;电极反应为SO2+2H2O-2e-=SO42-+4H+。
(4)A、温度升高,平衡逆向移动,逆反应速率增加的倍数大,A正确;B、图像的前半段为反应建立平衡的过程,SO3%逐渐增大,T1之后的阶段为化学反应随温度的升高平衡移动的过程,升高温度,平衡逆向移动SO3%逐渐减小,图像正确,B正确;C、600℃高于500℃,平衡逆向移动,SO3%逐渐减小,图像错误,C错误;D、增大压强,平衡正向移动,SO3%增大,图像正确,D正确,答案选ABD。
(5)①平衡常数只与温度有关系,温度不变,平衡常数不变,即K(A)=K(B)。
②将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,压强增大,物质的浓度瞬间变为原来的2倍,平衡向正反应方向进行,在第8分钟达到新的平衡(此时SO3的浓度为0.25 mol·L-1),则此变化过程中SO3(g)浓度的变化曲线可表示为 。
。


科目:高中化学 来源: 题型:
【题目】下表中物质甲物质一定条件下与乙组中的4种物质都能发生反应的是( )
选项 | 甲物质 | 乙组中的物质 |
A | SO2 | 淀粉碘化钾溶液、氨水、KMnO4溶液、碳酸钠溶液 |
B | Mg | Cl2、CO2、NH4Cl溶液、NaOH溶液 |
C | SiO2 | 碳、NaOH溶液、氢氟酸、Na2CO3 |
D | 稀硫酸 | Al(OH)3、碳、Cu2(OH)2CO3、Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应X2(g)+H2(g)![]() 2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A. 5% B. 17% C. 25% D. 33%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,错误的是(
A.浓硫酸常见的特性是吸水性、脱水性、氧化性
B.浓硫酸也具有酸性,在常温下能够与活泼金属铁、铝等反应放出氢气
C.氟化氢的热稳定性很好,具有极弱的还原性,为一元弱酸
D.SO2、SO3都是酸性氧化物,具有酸性氧化物的通性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物所表示的物质的分子式。
(1)![]() ___________________;
___________________;
(2)![]() ___________________;
___________________;
(3)![]() ___________ ;
___________ ;
(4)![]() __________________
__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂。完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
② MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O(未配平)
(1)下列关于反应①的说法中错误的是 (选填编号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.还原性的强弱关系是: Mn2+<Cu2S
d.生成2.24 L(标况下) SO2,转移电子的物质的量是0.6mol
(2)标出反应②中电子转移的方向和数目: MnO4-+ CuS
Ⅱ.在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-→ 2H++O2↑
还原反应:MnO4-+5e-+8H+→Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为 。由上述反应得出的物质氧化性强弱的结论是 >_________(填写化学式)。
(4)已知:2KMnO4+7H2O2+3H2SO4→ K2SO4+2MnSO4+6O2↑+10H2O,则被1molKMnO4氧化的H2O2是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(物质结构与性质)砷的一些化合物常用作半导体、除草剂、杀鼠药等。回答下列问题:
(1)基态As原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)稼氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大至小的顺序是____________
(3) As4O6的分子结构如图所示, 其中As原子的杂化方式为_________,1 molAs406含有σ键的物质的量为___________mol 。
其中As原子的杂化方式为_________,1 molAs406含有σ键的物质的量为___________mol 。
(4)As与N是同主族元素,AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是____________
(5)H3AsO4和H3AsO3是砷的两种含氧酸,根据结构与性质的关系,H3AsO4的酸性比H3AsO3Asq 强的原因是_________________
(7)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,

其中原子坐标参数A 处Li 为(0,0,1/2);B处As为(1/4,1/4;1/4);C处Li的坐标参数为__________。
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs 单晶的晶胞参数,a ="594pm" , NA表示阿伏加德罗常数的数值,其密度为__________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 煤的干馏和石油的分馏均属化学变化
B. 液化石油气和天然气的主要成分都是甲烷
C. 石油裂解、裂化和重整都是有机高分子生成小分子的过程
D. 煤油可由石油分馏获得,可用作燃料和保存少量金属钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com