
【题目】下表中物质甲物质一定条件下与乙组中的4种物质都能发生反应的是( )
选项 | 甲物质 | 乙组中的物质 |
A | SO2 | 淀粉碘化钾溶液、氨水、KMnO4溶液、碳酸钠溶液 |
B | Mg | Cl2、CO2、NH4Cl溶液、NaOH溶液 |
C | SiO2 | 碳、NaOH溶液、氢氟酸、Na2CO3 |
D | 稀硫酸 | Al(OH)3、碳、Cu2(OH)2CO3、Cu |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,这种有机物不可能具有的性质是( )

①可以与氢气发生加成反应;②能使酸性KMnO4溶液褪色;③能跟NaOH溶液反应; ④能发生酯化反应;⑤能发生加聚反应;⑥能发生水解反应.
A.①④ B.只有⑥
C.只有⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
A. 从开始到平衡A的平均反应速率为0.3mol/(L![]() s)
s)
B. 从开始到平衡B的转化率为60%
C. 此反应的化学平衡常数表达式![]()
D. 若混合气体的密度不再改变时,该反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+ H2(g)![]() CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:

【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g) ΔH3=44.0kJ·mol-1
H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K= ;反应II的ΔH2= kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有 。
A.使用催化剂Cat.1 B.使用催化剂Cat.2 C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在一定条件下反应,可以制得较纯净的1,2—二氯乙烷的是( )
A. 乙烷与氯气光照反应
B. 乙烯与氯化氢气体混合
C. 乙烯与氯气混合
D. 乙烯通入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是 ( )
A.v(N2)=0.1mol·L-1·s-1 B.v(H2)=0.1mol·L-1·min-1
C.v(NH3)=0.15mol·L-1·min-1 D.v(H2)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有位于周期表中的七种元素,试按下述所给的条件推断。
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F在常温下是气体,性质稳定,是除氢气外最轻的气体。
④G是除氢外原子半径最小的元素(不考虑稀有气体)。
(1)A的名称是________;B位于周期表中第______周期,第________族;C的原子结构示意图是________。
(2)E单质的颜色是________。
(3)A元素与D元素形成化合物的电子式是___________。
(4)G的单质与水反应的化学方程式是______________________________。
(5)F的元素符号是________。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是______;气态氢化物最稳定的化学式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了更好地解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源。以下做法不能提高燃料效率的是 ( )
A.煤的气化与液化
B.液体燃料呈雾状喷出
C.通入大量的空气
D.将煤块粉碎
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】工业制硫酸,利用催化氧化反应将SO2转化为SO3是一个关键步骤。请回答:
(1)某温度下,SO2(g)+O2(g)![]() SO3(g) ;ΔH=-98 kJ · mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
SO3(g) ;ΔH=-98 kJ · mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
(2)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 molO2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
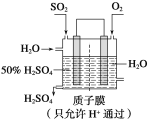
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______。
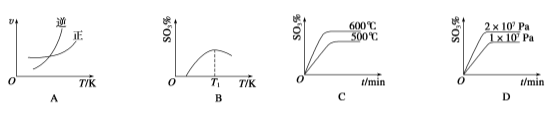
(4)下列关于2SO2(g)+O2(g)![]() 2SO3(g)反应的图像中,一定正确的是________(填序号)。
2SO3(g)反应的图像中,一定正确的是________(填序号)。
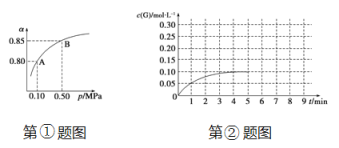
(5)①某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。当平衡状态由A变到B时,平衡常数K(A)_______ K(B)(填“>”、“<”或“=”)。
②将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度为0.25 mol·L-1)。请在下图画出此变化过程中SO3(g)浓度的变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com