
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+ H2(g)![]() CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:

【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g) ΔH3=44.0kJ·mol-1
H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K= ;反应II的ΔH2= kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有 。
A.使用催化剂Cat.1 B.使用催化剂Cat.2 C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 。
【答案】(1)![]() +41.2
+41.2
(2)CD
(3)表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响。
【解析】
试题分析:(1)根据平衡常数的公式,生成物的浓度幂之积与反应物浓度的幂之积的比值书写平衡常数为![]() 。有热化学方程式为:a:CO(g)+
。有热化学方程式为:a:CO(g)+![]() O2(g)=CO2(g) △H= -283.0kJ·mol-1 b:H2(g)+
O2(g)=CO2(g) △H= -283.0kJ·mol-1 b:H2(g)+![]() O2(g)=H2O (l)△H=-285.8kJ·mol-1 c: H2O(l)
O2(g)=H2O (l)△H=-285.8kJ·mol-1 c: H2O(l)![]() H2O(g) ΔH3=44.0kJ·mol-1根据盖斯定律分析,b-a+c即可得热化学方程式为:CO2(g)+ H2(g)
H2O(g) ΔH3=44.0kJ·mol-1根据盖斯定律分析,b-a+c即可得热化学方程式为:CO2(g)+ H2(g)![]() CO(g)+H2O(g)ΔH2=-285.8+283.0+44=+41.2 kJ·mol-1。(2)反应Ⅰ中A、使用催化剂,平衡不移动,不能提高转化率,错误;B、使用催化剂,平衡不移动,不能提高转化率,错误;C、降低反应温度,平衡正向移动,提高二氧化碳的转化率,正确;D、投料比不变,增加反应的浓度,平衡正向移动,提高二氧化碳的转化率,正确;E、增大二氧化碳和氢气的初始投料比,能提高氢气的转化率,二氧化碳的会降低,故错误。故选CD。(3)从表格数据分析,在相同的温度下,不同的催化剂,其二氧化碳的转化率也不同,说明不同的催化剂的催化能力不同;相同催化剂不同的温度,二氧化碳的转化率不同,且温度高的转化率大,因为正反应为放热反应,说明表中数据是未到平衡数据。所以答案为:表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响。
CO(g)+H2O(g)ΔH2=-285.8+283.0+44=+41.2 kJ·mol-1。(2)反应Ⅰ中A、使用催化剂,平衡不移动,不能提高转化率,错误;B、使用催化剂,平衡不移动,不能提高转化率,错误;C、降低反应温度,平衡正向移动,提高二氧化碳的转化率,正确;D、投料比不变,增加反应的浓度,平衡正向移动,提高二氧化碳的转化率,正确;E、增大二氧化碳和氢气的初始投料比,能提高氢气的转化率,二氧化碳的会降低,故错误。故选CD。(3)从表格数据分析,在相同的温度下,不同的催化剂,其二氧化碳的转化率也不同,说明不同的催化剂的催化能力不同;相同催化剂不同的温度,二氧化碳的转化率不同,且温度高的转化率大,因为正反应为放热反应,说明表中数据是未到平衡数据。所以答案为:表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响。


科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒。实验室通过如下过程制备二氧化氯。
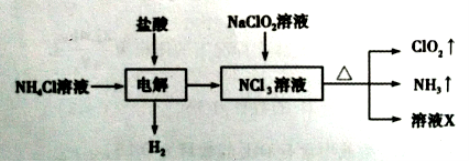
下列说法正确的是( )
A.电解时发生反应的离子方程式为NH4++3Cl-![]() 2H2↑+NCl3
2H2↑+NCl3
B.溶液X中大量存在的阴离子有Cl-、OH-
C.可用饱和食盐水除去ClO2中的NH3
D.可用明矾除去饮用水中残留的NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态烃和溴水发生加成反应生成2,3﹣二溴﹣2﹣甲基丁烷,则该烃是( )
A.3﹣甲基﹣1﹣丁烯 B.2﹣甲基﹣2﹣丁烯
C.2﹣甲基﹣1﹣丁烯 D.1﹣甲基﹣2﹣丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
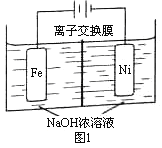

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨与制备硝酸一般可连续生产,流程如下:


(1)在合成氨的反应中,改变反应条件,会使平衡发生移动。如下图像表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号)_________,当横坐标为温度时,变化趋势正确的是(选填字母序号)_________。
(2)如图所示三个容积相同的容器①、②、③,若起始温度相同,
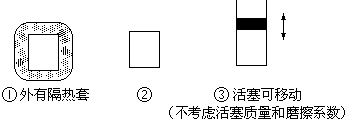
分别向三个容器中充入3mol H2和1mol N2,一定条件下反应,达到平衡时各容器中NH3物质的百分含量由小到大的顺序为(填容器编号)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是 ( )
2AB(g)达到平衡的标志是 ( )
A.混合气体中各物质的浓度相等。
B.单位时间内生成2nmolAB同时生成nmolB2 。
C.单位时间内生成nmolA2同时生成nmolB2 。
D.单位时间内生成nmolA2同时生成nmolAB 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中物质甲物质一定条件下与乙组中的4种物质都能发生反应的是( )
选项 | 甲物质 | 乙组中的物质 |
A | SO2 | 淀粉碘化钾溶液、氨水、KMnO4溶液、碳酸钠溶液 |
B | Mg | Cl2、CO2、NH4Cl溶液、NaOH溶液 |
C | SiO2 | 碳、NaOH溶液、氢氟酸、Na2CO3 |
D | 稀硫酸 | Al(OH)3、碳、Cu2(OH)2CO3、Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好完全沉淀(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol·L1,此时溶液中c(CrO42)等于__________ mol·L1。(已知Ag2 CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,错误的是(
A.浓硫酸常见的特性是吸水性、脱水性、氧化性
B.浓硫酸也具有酸性,在常温下能够与活泼金属铁、铝等反应放出氢气
C.氟化氢的热稳定性很好,具有极弱的还原性,为一元弱酸
D.SO2、SO3都是酸性氧化物,具有酸性氧化物的通性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com