
����Ŀ�������Ƿ�չ�е�����Դ���������ð�������Ʊ��������Ӧ���������ڡ��ش��������⣺
��1����������ȣ�������Ϊȼ�ϵ��ŵ���_________(���ٴ������)����������ֱ��ȼ�յ�����ת����Զ����ȼ�ϵ�أ�д����������ȼ�ϵ�صĸ�����Ӧʽ��____________��
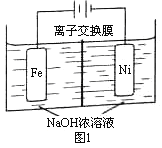
��5�����������ĸ�����Ҳ����������Դ����ⷨ��ȡ�й㷺��;��Na2FeO4��ͬʱ���������Fe+2H2O+2OH![]() FeO42+3H2��������ԭ����ͼ1��ʾ��װ��ͨ������缫���������Ϻ�ɫ��FeO42�����缫�����ݲ�����������������ҺŨ�ȹ��ߣ����缫����������ɫ���ʡ���֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ��
FeO42+3H2��������ԭ����ͼ1��ʾ��װ��ͨ������缫���������Ϻ�ɫ��FeO42�����缫�����ݲ�����������������ҺŨ�ȹ��ߣ����缫����������ɫ���ʡ���֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ��

�����һ��ʱ���c(OH)���͵�������_______(������������������������)��
���������У��뽫�������������弰ʱ�ų�����ԭ����_______��
��c( Na2FeO4)���ʼc(NaOH)�ı仯��ͼ2����ѡM��N�����е�һ�㣬����c(Na2FeO4)�������ֵ��ԭ��_____________��
���𰸡�
��1����ȾС������������Դ�㣻��Դ�ḻ��ȼ����ֵ�ߣ�H2+2OH--2e-=2H2O
��5����������
����ֹNa2FeO4��H2��Ӧʹ���ʽ���
��M�㣺c(OH-)�ͣ�Na2FeO4�ȶ��Բ�ҷ�Ӧ��(��N�㣺c(OH-)���ߣ����缫���������������ɣ�ʹNa2FeO4���ʽ���)��
��������
�����������1����������ȣ�������Ϊȼ�ϵ��ŵ�����ȾС������������Դ�㣻��Դ�ḻ��ȼ����ֵ�ߵȣ���������ȼ�ϵ�صĸ�����ӦʽΪH2+2OH--2e-=2H2O���ʴ�Ϊ����ȾС������������Դ�㣻��Դ�ḻ��ȼ����ֵ�ߣ�H2+2OH--2e-=2H2O
��5���������������缫�����ݲ����������ӷŵ��������������缫����������Ӧ����Һ�е����������Ӽ��٣���˵��һ��ʱ���c(OH)���͵������������ң��ʴ�Ϊ�������ң�
���������л�ԭ�ԣ���������Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ���������У��뽫�������������弰ʱ�ų�����ֹNa2FeO4��H2��Ӧʹ���ʽ��ͣ��ʴ�Ϊ����ֹNa2FeO4��H2��Ӧʹ���ʽ��ͣ�
����������Na2FeO4ֻ��ǿ�����������ȶ�����M�㣬c(OH-)�ͣ�Na2FeO4�ȶ��Բ�ҷ�Ӧ������N�㣺c(OH-)���ߣ����缫���������������ɣ�ʹNa2FeO4���ʽ��ͣ��ʴ�Ϊ��M�㣺c(OH-)�ͣ�Na2FeO4�ȶ��Բ�ҷ�Ӧ��(��N�㣺c(OH-)���ߣ����缫���������������ɣ�ʹNa2FeO4���ʽ���)��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2016����ɽ��ģ������������һ�ֹ�ҵ�Σ������ʳ�ηdz����ƣ����Խ�ǿ��ij��ѧ��ȤС���ʳ�����������ƽ��ж�Ƕ�̽����
��һ������NaCl��NaNO2
��ͬѧ�ó���������
���飺������Ksp(AgNO2)=2��10-8�� Ksp(AgCl)=1.8��10-10���ֱ���ʢ��5mL 0.0001 mol/L��������Һ���Ժ���ͬʱ��εμ�0.0001mol/L��������Һ�������ɳ�������װ�� ��Һ���Թܡ�
��ͬѧ�ඨ��ҺpH
��pH��ֽ�ֱ�ⶨ0.1 mol/L��������Һ��pH�����NaNO2��Һ�ʼ��ԡ�����Һ�ʼ��Ե�ԭ���� �������ӷ���ʽ���ͣ���
��������С��������װ�ã���ȥ�г��������Ʊ���������

��֪���� 2NO+ Na2O2 = 2NaNO2 ��
�� ���������£�NO��NO2������MnO4һ��Ӧ����NO3һ��Mn2+��
��1��ʹ��ͭ˿���ŵ��� ��
��2��װ��A�з�Ӧ����ʽΪ ��
װ��C ��ʢ�ŵ�ҩƷ�� ��������ĸ���ţ�
A��Ũ���� B��NaOH ��Һ C��ˮ D�����Ȼ�̼
����F������ ��
��3����С���ȡ5.000g��ȡ����Ʒ����ˮ���250.0 mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
����� | 1 | 2 | 3 | 4 |
����KMnO4��Һ���/mL | 20.70 | 20.12 | 20.00 | 19.88 |
�� ��һ��ʵ�����ݳ����쳣����������쳣��ԭ������� ������ĸ���ţ���
A����ƿϴ����δ����
B����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
C���ζ��յ�ʱ���Ӷ���
������KMnO4��Һ�ζ�����������Һ�����ӷ���ʽΪ ��
������Ʒ���������Ƶ���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����A��B�����2L�ܱ������з������·�Ӧ��3A��g��+B��g�� ![]() xC��g��+2D��g����4minʱ���D��Ũ��Ϊ0.4mol/L��c��A��:c��B��=3:5��C��ƽ����Ӧ������0.1mol/��L��min������ʽ���㣺
xC��g��+2D��g����4minʱ���D��Ũ��Ϊ0.4mol/L��c��A��:c��B��=3:5��C��ƽ����Ӧ������0.1mol/��L��min������ʽ���㣺
��1��x=__________��
��2��B����4min�ڵ�ƽ����Ӧ����__________��
��3����ʱA��Ũ�ȼ���Ӧ��ʼǰ������A��B�����ʵ���__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���Ա������һ����ˮ����أ����ܷ�ӦΪ��5MnO2 +2Ag+2NaCl =Na2 Mn5O10 +2AgCl����ͼ����ˮ�����Ϊ��Դ���NaCI��Һ��ʵ���У�X�缫������ɫ�����ݳ��������йط�����ȷ������ ��

A��IΪ��������缫��ӦʽΪAgʮCl-+e-=AgCl
B����ˮ�������Na+�������������ƶ�
C��ÿת��1mole-��U��������0��5mol H2O
D����ʼʱU����Y������pH������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���3molA��1molB�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)+B(g)![]() xC(g)+2D(s)��2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD�������C��Ũ��Ϊ0.2mol/L�������ж���ȷ����
xC(g)+2D(s)��2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD�������C��Ũ��Ϊ0.2mol/L�������ж���ȷ����
A. �ӿ�ʼ��ƽ��A��ƽ����Ӧ����Ϊ0.3mol/(L![]() s)
s)
B. �ӿ�ʼ��ƽ��B��ת����Ϊ60%
C. �˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ![]()
D. �����������ܶȲ��ٸı�ʱ���÷�Ӧһ���ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����
��1��Ŀǰ��ҵ����һ�ַ�������CO2��H2��230������������ת�����ɼ״���CH3OH��������ˮ����CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g������ͼ��ʾ��ѹ�����г���1mol CO2��3 mol H2��ת���ʴ�50%ʱ�������仯ʾ��ͼ��д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
CH3OH��g��+H2O��g������ͼ��ʾ��ѹ�����г���1mol CO2��3 mol H2��ת���ʴ�50%ʱ�������仯ʾ��ͼ��д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��

��2�����ҵ�ϻ�����CO��H2�Ʊ��״��� ��ӦΪCO��g��+2H2��g��![]() CH3OH��g����
CH3OH��g����
ij�¶��£����ݻ�Ϊ2L�ĺ����ܱ������н��и÷�Ӧ����������ݼ���ͼ��

�� t min��2t minʱ���ʱ仯��ԭ������� ��
�� 3t minʱ�Է�Ӧ��ϵ��ȡ��һ����ʩ����4t minʱCO�����ʵ���Ϊ0.5mol���������ͼCO�����ߡ�
��3��CO2��һ�������£���������H2�ϳɶ����ѣ�
2CO2��g��+6H2��g��![]() CH3OCH3��g��+3H2O��g����
CH3OCH3��g��+3H2O��g����
��2.5 mol H2��b mol CO2�����ݻ�Ϊ1 L���ܱ������У�����������Ӧ���ﵽƽ��״̬ʱ�����ʵ���������±���

�� ����ʱ������ƽ����_________�����ƶ��������Ӧ�����淴Ӧ������
�ڱ���x��y�Ĵ�С��ϵΪ_________��
A��x��y B��x��y C��x��y D�����ж�
�۱���x��y��z��w��Ӧ��ƽ�ⳣ���ֱ�ΪKx��Ky��Kz��Kw������֮��Ĵ�С��ϵΪ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭCO2�ǽ������ЧӦ����Դ�������Ҫ�ֶ�֮һ���о���������Cu/ZnO���������£�CO2��H2�ɷ�������ƽ�ⷴӦ���ֱ�����CH3OH��CO����Ӧ���Ȼ�ѧ����ʽ���£�
CO2��g��+3 H2��g��![]() CH3OH��g��+H2O��g����H1=-53.7kJ��mol-1 I
CH3OH��g��+H2O��g����H1=-53.7kJ��mol-1 I
CO2��g��+ H2��g��![]() CO��g��+H2O��g����H2 II
CO��g��+H2O��g����H2 II
ijʵ���ҿ���CO2��H2��ʼͶ�ϱ�Ϊ1:2.2��������ͬ��Ӧʱ��������ʵ�����ݣ�

����ע��Cat.1:Cu/ZnO���װ���Cat.2:Cu/ZnO����Ƭ���״�ѡ���ԣ�ת����CO2�����ɼ�ȩ�İٷֱ�
��֪����CO��H2�ı�ȼ���ȷֱ�Ϊ-283.0kJ��mol-1��-285.8kJ��mol-1
��H2O��l��![]() H2O��g�� ��H3=44.0kJ��mol-1
H2O��g�� ��H3=44.0kJ��mol-1
��ش𣨲������¶ȶ���H��Ӱ�죩��
��1����ӦI��ƽ�ⳣ������ʽK= ����ӦII����H2= kJ��mol-1��
��2�����������CO2ת��ΪCH3OHƽ��ת���ʵĴ�ʩ�� ��
A��ʹ�ô���Cat.1 B��ʹ�ô���Cat.2 C�����ͷ�Ӧ�¶�
D��Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ�� E������CO2��H2�ij�ʼͶ�ϱ�
��3������ʵ�����ݱ���������ͬ�¶��²�ͬ�Ĵ�����CO2ת����CH3OH��ѡ������������Ӱ�죬��ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĸ���ͬ�����У���ͬ�����½��кϳɰ���Ӧ����������ͬʱ���ڲⶨ�Ľ���ж����ɰ������������� ( )
A��v(N2)=0.1mol��L-1��s-1 B��v(H2)=0.1mol��L-1��min-1
C��v(NH3)=0.15mol��L-1��min-1 D��v(H2)=0.3mol��L-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L 1.0molL-1NaOH��Һ����0.8molSO2��������Һ�е�SO32-��HSO3-�����ʵ���Ũ��֮����ӽ���( )
A��2:1 B��1:3 C��3:2 D��2:3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com