
【题目】将等物质的量的A、B混合于2L密闭容器中发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),4min时测得D的浓度为0.4mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L.min),列式计算:
xC(g)+2D(g),4min时测得D的浓度为0.4mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L.min),列式计算:
(1)x=__________;
(2)B在这4min内的平均反应速率__________;
(3)此时A的浓度及反应开始前容器中A、B的物质的量__________。
【答案】
(1)x=2;
(2) 0.05 mol/(L·min);
(3)0.6 mol/L;2.4mol
【解析】
试题分析:(1)C的平均反应速率是0.1mol/(Lmin),则生成C是0.1mol/(Lmin)×2L×4min=0.8mol,生成D的物质的量为0.4mol/L×2L=0.8mol,根据变化量之比等于相应的化学计量数之比可知,x=2。
(2)根据化学反应速率之比等于化学计量数之比,v (B)=1/2v (c)=1/2×0.1 mol/(L.min)= 0.05 mol/(L·min)。
(3)根据三段式解答:3A(g)+B(g)![]() 2C(g)+2D(g)
2C(g)+2D(g)
起始量(mol) n n 0 0
转化量(mol) 1.2 0.4 0.8 0.8
平衡量(mol) n-1.2 n-0.4 0.8 0.8
所以有(n-1.2):(n-0.4)=3:5,解得n=2.4mol,所以此时A物质的浓度是1.2mol÷2L=0.6mol/L;反应开始前容器中A、B的物质的量为2.4mol。


科目:高中化学 来源: 题型:
【题目】下列有关生活中的化学叙述不正确的是( )
A.无法用米汤(含淀粉)检验加碘盐中的碘酸钾(KIO3)
B.用聚乙烯制造的塑料薄膜可用于包装食品
C.蚕丝、羊毛、棉花的主要成分都是蛋白质
D.75℅的酒精可用于医用消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒。实验室通过如下过程制备二氧化氯。
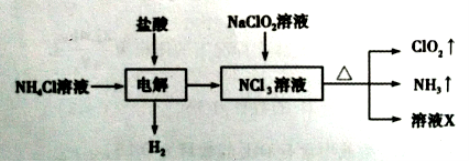
下列说法正确的是( )
A.电解时发生反应的离子方程式为NH4++3Cl-![]() 2H2↑+NCl3
2H2↑+NCl3
B.溶液X中大量存在的阴离子有Cl-、OH-
C.可用饱和食盐水除去ClO2中的NH3
D.可用明矾除去饮用水中残留的NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表给出五种短周期元素的相关信息。
元素 | 相关信息 |
A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
D | 室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |
请按要求回答下列问题:
(1)D元素核外电子排布 ;
(2)A、B两元素形成的含有非极性键的化合物的结构式 ;A、B两元素形成的具有相同电子数的离子有(填化学式):______________、_____________。
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(4)一定条件下,在水溶液中1 mol E-、EO(x=1,2,3,4)的能量(kJ)相对大小如图所示。n是 (填离子符号)。离子反应y→x+m的热化学方程式为 。

(5)Na2DB3水溶液中各离子浓度的大小顺序是 (填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+ H2(g)![]() CO(g)+H2O(g)ΔH2 II
CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:

【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g) ΔH3=44.0kJ·mol-1
H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K= ;反应II的ΔH2= kJ·mol-1。
(4)在图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态烃和溴水发生加成反应生成2,3﹣二溴﹣2﹣甲基丁烷,则该烃是( )
A.3﹣甲基﹣1﹣丁烯 B.2﹣甲基﹣2﹣丁烯
C.2﹣甲基﹣1﹣丁烯 D.1﹣甲基﹣2﹣丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
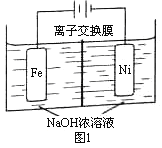

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好完全沉淀(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol·L1,此时溶液中c(CrO42)等于__________ mol·L1。(已知Ag2 CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,反应的离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com