
【题目】写出下列有机物所表示的物质的分子式。
(1)![]() ___________________;
___________________;
(2)![]() ___________________;
___________________;
(3)![]() ___________ ;
___________ ;
(4)![]() __________________
__________________
【答案】(1)C8H18(2)C6H12(3)C4H8Br2 (4)C9H8O2
【解析】试题分析:(1)键线式中每个折点和线端点处表示有一个碳原子,并以氢原子补足四键,故此有机物中含8个碳原子,18个氢原子,故分子式为C8H18,故答案为:C8H18;
(2)键线式中每个折点和线端点处表示有一个碳原子,并以氢原子补足四键,故此有机物中含6个碳原子,12个氢原子,故分子式为C6H12,故答案为:C6H12;
(3)键线式中每个折点和线端点处表示有一个碳原子,并以氢原子补足四键,故此有机物中含5个碳原子,10个氢原子,2个Br原子,故分子式为C5H10Br2,故答案为:C5H10Br2;
(4)键线式中每个折点和线端点处表示有一个碳原子,并以氢原子补足四键,故此有机物中含9个碳原子,8个氢原子,2个O原子,故分子式为C9H8O2,故答案为:C9H8O2。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质在一定条件下反应,可以制得较纯净的1,2—二氯乙烷的是( )
A. 乙烷与氯气光照反应
B. 乙烯与氯化氢气体混合
C. 乙烯与氯气混合
D. 乙烯通入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol/L两种气体X2和Y2,在密闭容器中反应生成气体Z ,经过t min后,测得物质的浓度为 (X2)=0.4mol/L,c(Y2)=0.8mol/L,c(Z)=0.4mol/L,则该反应的反应式可表示为( )
A.X2+2Y2=2Z B.2X2 +2Y2=2Z
C.3X2+Y2=2Z D.X2+3Y2=2Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
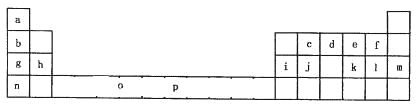
试回答下列问题:
(1)元素p为26号元素,请画出其基态原子外围电子排布图______________;
(2)e与a反应的产物的分子中中心原子的杂化形式为________________;该分子是_________(填“极性”或“非极性”)分子。
(3)上表中元素基态原子的第一电离最大的元素是__________。(用元素符号表示)
(4)o、p两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难,对此,你的解释是______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在国际环境问题中,一次性使用的聚苯乙烯材料带来的“白色污染”甚为突出。这种材 料难以分解,处理麻烦。最近研究制出一种新型的材料能替代聚苯乙烯。它是由乳酸缩 聚而生成的,该种材料可在乳酸菌作用下发生降解,下列关于聚乳酸的说法正确的是
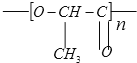
A.聚乳酸是一种纯净物
B.其聚合方式与聚苯乙烯相似
C.其单体为CH3-CH(OH)-COOH
D.聚乳酸是一种线型高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】工业制硫酸,利用催化氧化反应将SO2转化为SO3是一个关键步骤。请回答:
(1)某温度下,SO2(g)+O2(g)![]() SO3(g) ;ΔH=-98 kJ · mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
SO3(g) ;ΔH=-98 kJ · mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=________ 。
(2)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是________(填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 molO2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
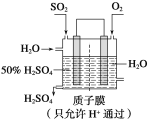
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______。
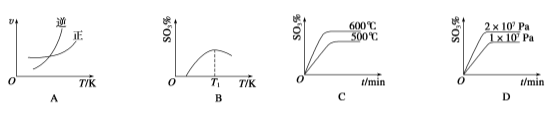
(4)下列关于2SO2(g)+O2(g)![]() 2SO3(g)反应的图像中,一定正确的是________(填序号)。
2SO3(g)反应的图像中,一定正确的是________(填序号)。
(5)①某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。当平衡状态由A变到B时,平衡常数K(A)_______ K(B)(填“>”、“<”或“=”)。
②将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度为0.25 mol·L-1)。请在下图画出此变化过程中SO3(g)浓度的变化曲线。
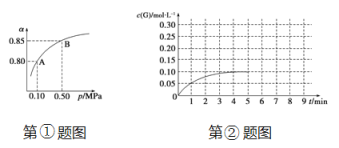
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ /mol;HCl(aq)与NaOH(aq)反应的△H =-55.6kJ/ mol。则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ /mol B. -43.5kJ /mol C. +43.5 kJ/ mol D. +67.7 kJ/ mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届邯郸一模】【化学选修3:物质结构与性质】
新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高能层符号为_________,该能层具有的原子轨道数为________。
②LiBH4由Li+和BH4-构成,BH4-的立体结构是_________,B原子的杂化轨道类型是________。
Li、B、H元素的电负性由大到小排列顺序为________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径Li+_______H-(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 | I4/kJmol-1 | I5/kJmol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是________ (填元素符号)。
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为________,NaH的理论密度是___________g·cm-3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。

完成下列填空:
(1)实验时,通常加入过量的乙醇,原因是______________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________;浓硫酸用量又不能过多,原因是____________。
(2)饱和Na2CO3溶液的作用是_______________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com