
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
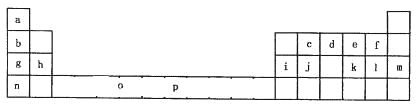
试回答下列问题:
(1)元素p为26号元素,请画出其基态原子外围电子排布图______________;
(2)e与a反应的产物的分子中中心原子的杂化形式为________________;该分子是_________(填“极性”或“非极性”)分子。
(3)上表中元素基态原子的第一电离最大的元素是__________。(用元素符号表示)
(4)o、p两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难,对此,你的解释是______________;
【答案】(1)![]() (2)sp3极性 (3) Ar (4)Mn2+的3d轨道电子为半充满状态较稳定;
(2)sp3极性 (3) Ar (4)Mn2+的3d轨道电子为半充满状态较稳定;
【解析】试题分析:根据元素在周期表中的位置知,a、b、c、d、e、f、g、h、i、j、k、l、m、n、o、p元素分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe元素,
(1)元素p为26号元素,其3d、4s电子为其外围电子即价电子,3d能级上有6个电子、4s能级上有2个电子,其价电子排布式为3d64s2,电子排布图为![]() ;
;
(2)O2与H2反应生成的H2O分子,中心原子O的杂化形式为sp3,正负电荷重心不重合,所以为极性分子;
(3)惰性元素的电子排布为全充满结构,相对稳定,难失电子,第一电离大,则Ar的第一电离能最大;
(4)Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。


科目:高中化学 来源: 题型:
【题目】工业合成氨与制备硝酸一般可连续生产,流程如下:


(1)在合成氨的反应中,改变反应条件,会使平衡发生移动。如下图像表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号)_________,当横坐标为温度时,变化趋势正确的是(选填字母序号)_________。
(2)如图所示三个容积相同的容器①、②、③,若起始温度相同,
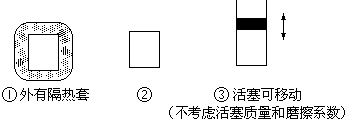
分别向三个容器中充入3mol H2和1mol N2,一定条件下反应,达到平衡时各容器中NH3物质的百分含量由小到大的顺序为(填容器编号)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把a、b、c、d四种金属片浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由大到小为( )
A.a>b>c>d
B.a>c>d>b
C.c>a>b>d
D.b>d>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应X2(g)+H2(g)![]() 2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A. 5% B. 17% C. 25% D. 33%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是重要的化工原料。
(1)工业上常用_______法生产氯气,写出发生反应的化学方程式:_________________________。
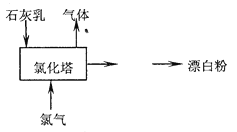
(2)工业上常用石灰乳和氯气反应制取漂白粉,化学反应方程式是____________________。部分流程如右图所示,其主要设备是氯化塔,,塔从上到下分四层.将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入,这样加科的目的是___________________________________。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是___________________,其原因可能是_____________________,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,错误的是(
A.浓硫酸常见的特性是吸水性、脱水性、氧化性
B.浓硫酸也具有酸性,在常温下能够与活泼金属铁、铝等反应放出氢气
C.氟化氢的热稳定性很好,具有极弱的还原性,为一元弱酸
D.SO2、SO3都是酸性氧化物,具有酸性氧化物的通性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物所表示的物质的分子式。
(1)![]() ___________________;
___________________;
(2)![]() ___________________;
___________________;
(3)![]() ___________ ;
___________ ;
(4)![]() __________________
__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂。完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
② MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O(未配平)
(1)下列关于反应①的说法中错误的是 (选填编号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.还原性的强弱关系是: Mn2+<Cu2S
d.生成2.24 L(标况下) SO2,转移电子的物质的量是0.6mol
(2)标出反应②中电子转移的方向和数目: MnO4-+ CuS
Ⅱ.在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-→ 2H++O2↑
还原反应:MnO4-+5e-+8H+→Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为 。由上述反应得出的物质氧化性强弱的结论是 >_________(填写化学式)。
(4)已知:2KMnO4+7H2O2+3H2SO4→ K2SO4+2MnSO4+6O2↑+10H2O,则被1molKMnO4氧化的H2O2是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究。
【定性实验】检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色.
(1)根据实验现象,推测碳铵中所含有阴离子可能是_______和_______;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是__________ __________;
【定量试验】测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图所示.

(3)碳铵固体应放在________中进行加热.
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(4)从安全的角度考虑,尾气处理的装置可以选用________;

(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_____g。
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量.请你评价该方案是否合理;________(填“合理”“不合理”),理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com