
【题目】把a、b、c、d四种金属片浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由大到小为( )
A.a>b>c>d
B.a>c>d>b
C.c>a>b>d
D.b>d>c>a
科目:高中化学 来源: 题型:
【题目】下列各组物质在一定条件下反应,可以制得较纯净的1,2—二氯乙烷的是( )
A. 乙烷与氯气光照反应
B. 乙烯与氯化氢气体混合
C. 乙烯与氯气混合
D. 乙烯通入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有位于周期表中的七种元素,试按下述所给的条件推断。
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F在常温下是气体,性质稳定,是除氢气外最轻的气体。
④G是除氢外原子半径最小的元素(不考虑稀有气体)。
(1)A的名称是________;B位于周期表中第______周期,第________族;C的原子结构示意图是________。
(2)E单质的颜色是________。
(3)A元素与D元素形成化合物的电子式是___________。
(4)G的单质与水反应的化学方程式是______________________________。
(5)F的元素符号是________。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是______;气态氢化物最稳定的化学式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是
A.盐酸和硫酸都属于化合物 B.SO2、SiO2、CO均为酸性氧化物
C.硝酸铵和醋酸都属于弱电解质 D.淀粉和蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了更好地解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源。以下做法不能提高燃料效率的是 ( )
A.煤的气化与液化
B.液体燃料呈雾状喷出
C.通入大量的空气
D.将煤块粉碎
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol/L两种气体X2和Y2,在密闭容器中反应生成气体Z ,经过t min后,测得物质的浓度为 (X2)=0.4mol/L,c(Y2)=0.8mol/L,c(Z)=0.4mol/L,则该反应的反应式可表示为( )
A.X2+2Y2=2Z B.2X2 +2Y2=2Z
C.3X2+Y2=2Z D.X2+3Y2=2Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
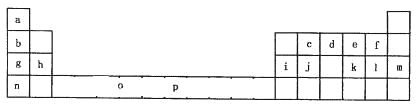
试回答下列问题:
(1)元素p为26号元素,请画出其基态原子外围电子排布图______________;
(2)e与a反应的产物的分子中中心原子的杂化形式为________________;该分子是_________(填“极性”或“非极性”)分子。
(3)上表中元素基态原子的第一电离最大的元素是__________。(用元素符号表示)
(4)o、p两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难,对此,你的解释是______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届邯郸一模】【化学选修3:物质结构与性质】
新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高能层符号为_________,该能层具有的原子轨道数为________。
②LiBH4由Li+和BH4-构成,BH4-的立体结构是_________,B原子的杂化轨道类型是________。
Li、B、H元素的电负性由大到小排列顺序为________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径Li+_______H-(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 | I4/kJmol-1 | I5/kJmol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是________ (填元素符号)。
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为________,NaH的理论密度是___________g·cm-3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com