
【题目】下列关于物质分类的说法正确的是
A.盐酸和硫酸都属于化合物 B.SO2、SiO2、CO均为酸性氧化物
C.硝酸铵和醋酸都属于弱电解质 D.淀粉和蛋白质都属于高分子化合物
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL 0.10mol![]() 氨水中滴入0.10 mol
氨水中滴入0.10 mol![]() 的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol
的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol![]() 氨水的电离度为1.32%,下列有关叙述正确的是( )
氨水的电离度为1.32%,下列有关叙述正确的是( )

A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届厦门一模】[化学——选修3:物质结构与性质]NO2+和NO2都是常见的配位体,易与金属结合生成配合物。
(1)基态氧原子核外未成对电子数有__________个,基态氮原子的核外电子轨道示意图为__________。
(2)NO2+和NO2-中氮原子的杂化轨道类型分别为__________。
(3)为消除雾霾利用金属氧化物吸收氮的氧化物,MgO、BaO、CaO、SrO吸收氮的氧化物能力由强到弱的顺序为____________。
(4)下表为含氧酸根XO4n-的键长数据:
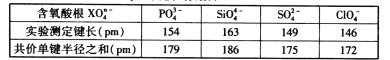
PO43-的空间构型为________。X-O之间的实测键长与理论键长有差异,其原因可能为X-O之间形成了多重键:首先是X原子的________轨道与O原子的2p轨道形成________键;其次是X原子的__________轨道与O原子的2p轨道形成________键。
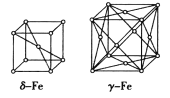
(5)铁有δ、γ两种晶体,如右图所示。两种晶体中距离最近的铁原子间距相同。δ -Fe中铁原子的配位数为__________,δ-Fe和γ-Fe的密度之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把a、b、c、d四种金属片浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由大到小为( )
A.a>b>c>d
B.a>c>d>b
C.c>a>b>d
D.b>d>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
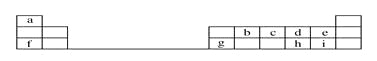
回答下列问题:
(1)元素b在元素周期表中的位置是________。
(2)元素a与c形成的4核10电子分子的化学式为________,其水溶液呈________性。
(3)元素e的负一价离子的结构示意图为________,元素g的简单离子的结构示意图为________,二者的离子半径大小顺序为________。
(4)元素i的气态氢化物比元素e的气态氢化物________(填“稳定”或“不稳定”)。
(5)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为______________,该化合物中所含的化学键类型为________________。
(6)元素d与h形成的化合物的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是重要的化工原料。
(1)工业上常用_______法生产氯气,写出发生反应的化学方程式:_________________________。
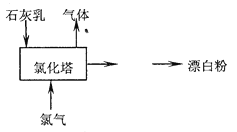
(2)工业上常用石灰乳和氯气反应制取漂白粉,化学反应方程式是____________________。部分流程如右图所示,其主要设备是氯化塔,,塔从上到下分四层.将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入,这样加科的目的是___________________________________。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是___________________,其原因可能是_____________________,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有分子式分别为CH4、C2H4、C3H4、C2H6、C3H6的五种有机物。相同质量的以上物质中,在相同状况下气体体积最大的是________;相同质量的以上物质完全燃烧时消耗O2的量最多的是________;相同状况、相同体积的以上五种物质完全燃烧时消耗O2的量最多的是________;相同质量的以上五种物质完全燃烧时,生成CO2最多的是________,生成H2O最多的是________;在120 ℃、1.01×105 Pa状态下,以任意比混合的三种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这三种气体是 ________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com