
【题目】A是一种常见的有机物,其产量可以作为衡量一个国家石油化工发展水平的标志,F是高分子化合物,有机物A可以实现如下转换关系。请回答下列问题:

(1)A的结构式为________。
(2)D中含氧原子团的名称为_____,④的化学反应类型为_______。
(3)请分别写出⑤、⑥的化学方程式__________、_________。
(4)在实验室中,可用下图所示装置制取少量G,试管a中盛放的试剂是____,其作用为_____。

【答案】 ![]() 羧基 取代反应(或酯化反应) CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH
羧基 取代反应(或酯化反应) CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH ![]() 饱和碳酸钠溶液 吸收乙醇,反应乙酸,降低乙酸乙酯的溶解度
饱和碳酸钠溶液 吸收乙醇,反应乙酸,降低乙酸乙酯的溶解度
【解析】A是一种常见的有机物,其产量可以作为衡量一个国家石油化工发展水平的标志,则A为乙烯,乙烯发生加聚反应生成F为聚乙烯;乙烯与水发生加成反应生成B为乙醇,乙醇与氧化发生氧化反应生成C为乙醛,乙醛继续氧化生成D为乙酸,乙酸与乙醇发生酯化反应生成G为乙酸乙酯,乙酸乙酯在氢氧化钠溶液中发生水解反应生成乙醇和E为乙酸钠。(1) A为乙烯,其结构式为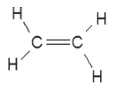 ;(2)D为乙酸,含氧原子团的名称为羧基,④是乙酸与乙醇发生酯化反应生成乙酸乙酯,化学反应类型为取代反应或酯化反应;(3)⑤是乙酸乙酯在氢氧化钠溶液中发生水解反应生成乙醇和乙酸钠,反应方程式为CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH;⑥是乙烯发生加聚反应生成聚乙烯;化学方程式为
;(2)D为乙酸,含氧原子团的名称为羧基,④是乙酸与乙醇发生酯化反应生成乙酸乙酯,化学反应类型为取代反应或酯化反应;(3)⑤是乙酸乙酯在氢氧化钠溶液中发生水解反应生成乙醇和乙酸钠,反应方程式为CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH;⑥是乙烯发生加聚反应生成聚乙烯;化学方程式为![]() ;(4)制取少量乙酸乙酯时,试管a中盛放的试剂是饱和碳酸钠溶液,其作用为吸收乙醇,反应乙酸,降低乙酸乙酯的溶解度。
;(4)制取少量乙酸乙酯时,试管a中盛放的试剂是饱和碳酸钠溶液,其作用为吸收乙醇,反应乙酸,降低乙酸乙酯的溶解度。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】下列关于卤素(用X表示)的叙述正确的是( )
A.HF、HCl、HBr、HI的稳定性依次增强
B.卤素单质与水都生成HX和HXO
C.其单质都有颜色,都有毒
D.卤素单质与其他物质化合时,均表现为还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物Targretin(F)能治疗顽固性皮肤T-细胞淋巴瘤,其合成路线如下图所示:

(1)反应①、②的反应类型分别是_________。
(2)反应④的化学方程式:_______________。
(3)E的结构简式是_____________________。
(4)如何检验D中的官能团________。
(5)F的分子式是C24H28O2。F中含有的官能团:_______。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑-O-O-或![]() 结构):_______________。
结构):_______________。
a.苯环上的一氯代物有两种 b.既能发生银镜反应又能发生水解反应
(7)已知: (R、R′为烃基))以HOCH2CH2OH为原料,选用必要的无机试剂合成
(R、R′为烃基))以HOCH2CH2OH为原料,选用必要的无机试剂合成![]() ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______________________________。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述,正确的是( )
A.在饱和氯化铁溶液中逐滴加入NaOH溶液,可制备氢氧化铁胶体
B.明矾净水利用了胶体的吸附性
C.电泳现象可以证明胶体带电
D.胶体粒子很小,可以透过滤纸和半透膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子的叙述,正确的是( )
A.阴离子中不可能含金属元素
B.金属离子参与氧化还原反应时,既可能被氧化又可能被还原
C.Na2O2中阴阳离子个数比是1:1
D.NaCl固体不能导电,是因为固体中不存在阴阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们常常利用化学反应中的能量变化为人类服务。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大最的热。氢气燃烧生成水蒸气的能最变化如下图所示:

根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着______变化,1molH2完全燃烧生成1molH2O(气态)时,释放的能量是_______kJ。
(2)下列化学反应在理论上可以设计成原电池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.CH4+2O2![]() CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

a.电流计指针偏转 |
b.Cu极有H2产生 |
c.H+向负极移动 |
d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是_______(填序号)。
②请写出该电池的负极反应式_________。
③若有1mol电子流过导线,则理论上产生H2的质量为______g.
④将稀H2SO4换成CuSO4溶液,电极质量增加的是______(填“锌极”或“铜极”,下同),溶液中SO42-移向_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= .
(2)该反应为反应(选填“吸热”、“放热”).
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡移动(选填“向正反应方向”、“向逆反应方向”、“不”).
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2molL﹣1、2molL﹣1、4molL﹣1、4molL﹣1 , 则此时上述反应的平衡移动方向为 . (选填“正反应方向”、“逆反应方向”、“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CrO42-+2H+![]() Cr2O72-+H2O。25℃时,调节初始浓度为1.0mol·L-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如下曲线。下列说法不正确的是( )
Cr2O72-+H2O。25℃时,调节初始浓度为1.0mol·L-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如下曲线。下列说法不正确的是( )

A. 平衡时,pH越小,c(Cr2O72-)越大
B. A、B两点c(CrO42-)之比为5:2
C. B点CrO42-的平衡转化率为40%
D. 平衡时,若溶液中c(CrO42-)=2c(Cr2O72-),则c(H+)=1.0×10-7mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com