
| A.同温、同浓度的钠盐溶液PH:NaA>NaB |
| B.PH相同的HA,HB的酸溶液,稀释相同倍数后,PH:HA<HB |
| C.中和等体积、等PH的HA,HB溶液时,HA消耗NaOH的物质的量多 |
| D.同温、同浓度的两种酸溶液,HA的电离程度大于HB的电离程度 |
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:不详 题型:单选题
| A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L |
| B.分别加水稀释100倍后,两种溶液的pH仍相同 |
| C.醋酸中的c(CH3COO-)和硫酸中的c(SO)相等 |
| D.分别加入足量锌片,两种溶液生成H2的体积相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.根据Ksp(PbI2)>Ksp(AgCl)可以得出PbI2在水中的溶解能力比AgCl大 |
| B.常温下,同浓度的Na2CO3与NaHCO3溶液相比,NaHCO3溶液的pH大 |
| C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大 |
| D.常温下pH=7的氨水与硫酸铵的混合液中c(NH4+)与c(SO42-)之比小于2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H++HS-②HS-
H++HS-②HS- H++S2-,且知K1>K2,采取下列哪种措施后,既可增大c(S2-)又能提高pH还能使电离平衡逆向移动的是( )
H++S2-,且知K1>K2,采取下列哪种措施后,既可增大c(S2-)又能提高pH还能使电离平衡逆向移动的是( )| A.加NaOH | B.通入H2S气体 |
| C.降温 | D.加入Na2S晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH相同的三种溶液,物质的量浓度最小的是HCl |
| B.物质的量浓度相同的三种溶液,pH最小的是H2SO4 |
| C.含溶质的物质的量相同的三种溶液与过量镁粉反应,CH3COOH产生的H2最多 |
| D.相同pH、相同体积的三种溶液用NaOH溶液完全中和时,消耗NaOH溶液一样多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
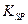 =2.6×10-39,Mg(OH)2的溶度积常数
=2.6×10-39,Mg(OH)2的溶度积常数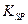 =5.6×
=5.6×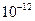 ,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;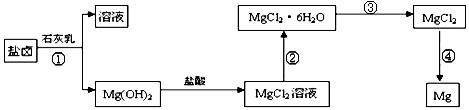
 .过程③的转化需要在HCl气流中加热,HCl的作用是
.过程③的转化需要在HCl气流中加热,HCl的作用是 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaOH=Na++OH- | B.CuSO4=Cu2++SO42- |
| C.H2SO4=2H++SO42- | D.KMnO4=K++Mn2+-+4O2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
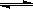 H++OH-,在25℃时水的离子积为:KW=1.0×10-14,在35℃时水的离子积为:KW=2.1×10-14,则下列叙述正确的是 ( )
H++OH-,在25℃时水的离子积为:KW=1.0×10-14,在35℃时水的离子积为:KW=2.1×10-14,则下列叙述正确的是 ( )| A.水的电离是个吸热过程 | B.35℃时c(H+)<c(OH-) |
| C.c(H+)随着温度的升高而降低 | D.35℃时的水比25℃时的水电离程度小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通入少量氯化氢气体 | B.加入少量水 |
| C.加入少量NaOH固体 | D.加入少量NH4Cl固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com