
【题目】下列叙述正确的是( )
A. 金刚石和石墨是同种物质
B. C60和 CO2均是碳元素的化合物
C. 氧气和臭氧是氧元素的同素异形体
D. 农村常用草木灰和碳酸氢铵一起施用来增加肥效
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】(1)接触法制硫酸工艺中,其主反应是在恒容、温度为450℃并有催化剂存在的条件下进行:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-190Kj/mol
2SO3(g) ΔH=-190Kj/mol
①下列描述中能说明上述反应已达平衡的是____________。
a. ![]() (O2)正=2
(O2)正=2![]() (SO3)逆 b.容器中气体的密度不随时间而变化
(SO3)逆 b.容器中气体的密度不随时间而变化
c.容器中气体的平均相对分子质量不随时间而变化 d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则![]() (O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
(O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol3) <_____mol。
(2)工业生成尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2(g) ![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①ΔH_______0(填“>”、“<”或“=”)
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。

③右图中的B点对应的NH3的平衡转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质(括号中为杂质),所用试剂和方法不正确的是
A. KCl溶液(I2):酒精,萃取
B. Fe(OH)3胶体(NaCl):渗析
C. Cl2(HCl):通过饱和食盐水洗气
D. NaHCO3溶液(Na2CO3):通入过量CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. 丁达尔效应可以用来鉴别胶体和溶液
B. 在水溶液中 NaHSO4 的电离:NaHSO4=Na++ HSO4-
C. 配置 FeSO4溶液时,需加入少量铁粉防止 Fe2+被氧化
D. 碳酸氢钠在医疗上可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质:
A.金刚石与石墨;B.淀粉与纤维素;C.氕与氘;D.甲烷与戊烷;E.葡萄糖与果糖
F. 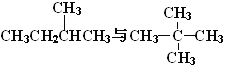 G.
G. 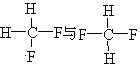
其中互为同位素的是____________(填编号,下同);互为同系物的是_______;互为同分异构体的是__________;是同一种物质的是_____________。
(2)化合物A的结构简式为: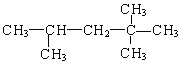 ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含氢原子种类最少的一种结构简式为:__________;若A是由烯烃和H2通过加成反应得到,写出该烯烃的所有可能的结构简式__________。
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含氢原子种类最少的一种结构简式为:__________;若A是由烯烃和H2通过加成反应得到,写出该烯烃的所有可能的结构简式__________。
(3)篮烷分子的键线式如图所示,试回答:

①写出篮烷分子的化学式____________;
②篮烷分子的一氯取代物的种数为_______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2+O22NO在密闭容器中进行,下列哪些条件能加快反应的速率
A. 缩小体积使压强增大B. 增大体积使压强减小
C. 体积不变充入H2使压强增大D. 压强不变充入N2使体积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)G位于周期表的____区(填“s”、“ p”、“d ”或“ds”)。
(2)画出W基态原子的核外电子排布图_______。
(3)A2Y的VSEPR模型名称为______。
(4)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理.写出X2Y的电子式____,其中心原子的杂化软道类型是______,1个X2Y分子中含的π键数为______。
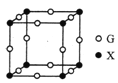
(5)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。
(6)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为
A.3︰2 B.1︰2 C.3︰1 D.6︰1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com