
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 0.1 mol•L-1 Na2CO3溶液中,存在关系:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| B. | 加热0.1 mol•L-1 NaClO溶液测其pH,pH小于9.7 | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液以等体积混合,则有c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | 根据上表数据得出三种酸电离平衡常数大小关系为:HF>HClO>H2CO3(一级电离平衡常数) |
分析 A.根据物料守恒:2[c(CO32-)+c(HCO3-)+c(H2CO3)]=c(Na+),根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-);
B.盐类水解是吸热反应,升高温度促进盐类水解;
C.常温下NaF溶液pH=7.5>7,NaF溶液呈碱性,说明NaF是强碱弱酸盐,则HF是弱酸;pH=2的HF浓度大于pH=12的NaOH溶液浓度,二者等体积混合HF有剩余,溶液呈酸性;
D.相同温度下,相同浓度的钠盐溶液中,弱酸根离子水解程度越大其溶液pH越大,酸根离子水解程度越大其相对应的酸的电离程度越小,即酸的电离平衡常数越小.
解答 解:A.A.根据物料守恒:2[c(CO32-)+c(HCO3-)+c(H2CO3)]=c(Na+),根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),所以得c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故A正确;
B.盐类水解是吸热反应,升高温度促进盐类水解NaClO溶液pH>7,则NaClO是强碱弱酸盐,升高温度促进其水解,溶液的碱性增强,pH增大,故B错误;
C.常温下NaF溶液pH=7.5>7,NaF溶液呈碱性,说明NaF是强碱弱酸盐,则HF是弱酸;pH=2的HF浓度大于pH=12的NaOH溶液浓度,二者等体积混合HF有剩余,溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒得c(Na+)<c(F-),酸的电离程度较小,则溶液中离子浓度大小顺序是c(F-)>c(Na+)c(H+)>c(OH-),故C错误;
D.相同温度下,相同浓度的钠盐溶液中,弱酸根离子水解程度越大其溶液pH越大,酸根离子水解程度越大其相对应的酸的电离程度越小,即酸的电离平衡常数越小,根据表中数据知,酸根离子水解程度F-<ClO-<CO32-,则酸的电离平衡常数HF>HClO>HCO3-,故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析推断能力,明确酸的电离程度与酸根离子水解程度关系、溶液中溶质成分及其性质是解本题关键,易错选项是D,注意碳酸根离子对应的酸是碳酸氢根离子而不是碳酸,题目难度不大.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨基钠和氢化钠与盐酸反应都只生成一种盐 | |
| B. | 方程式②中,每生成1mol H2转移1 mol电子 | |
| C. | 熔融氢化钠不导电 | |
| D. | 方程式①中,氨基钠是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
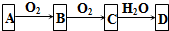
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
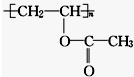
| A. | 1 mol 该有机物与 NaOH 溶液完全反应时,消耗 1 mol NaOH | |
| B. | 该有机物水解所得产物能发生酯化反应 | |
| C. | 该有机物可通过加聚反应生成 | |
| D. | 该有机物属于混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 2mol/L蔗糖溶液中所含分子数为0.4NA | |
| B. | 标准状况下,2.24L HF的氢原子数目为0.1 NA | |
| C. | 黑火药爆炸的方程式为2KNO3+3C+S═K2S+N2↑+3CO2↑,当生成1molK2S时转移电子数为2NA | |
| D. | 标准状况下,1.12L 1H2和0.2g2H2均含有0.1 NA质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同分异构体之间分子式相同,其式量也一定相等;式量相等的物质一定是同分异构体 | |
| B. | 某有机物燃烧后产物只有CO2和H2O,可推出的结论是有机物属于烃 | |
| C. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为CH3CH2OH | |
| D. | 分子式为C8H10的芳香烃有4种同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com