
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如图所示:
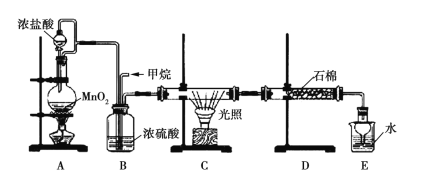
(1)A中制取Cl2的反应的化学方程式是_________________________。
(2)B装置的作用:①______;②______;③______。
(3)D装置中的石棉上吸附着潮湿的KI,其作用是________________。
(4)E装置的作用是_____(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(6)将1 mol CH4与Cl2发生取代反应,测得4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是_____。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 控制气流速度 使气体混合均匀 干燥气体 除去过量的Cl2 C 分液 2.5 mol
MnCl2+Cl2↑+2H2O 控制气流速度 使气体混合均匀 干燥气体 除去过量的Cl2 C 分液 2.5 mol
【解析】
甲烷与氯气在光照的条件下发生取代反应生成多种氯代甲烷和氯化氢。A装置是浓盐酸和二氧化锰制取氯气的发生装置,通过B装置,除去氯气中的水蒸气,控制两种气体的流速,使氯气和甲烷混合均匀,C装置是甲烷和氯气发生取代反应的装置,D装置盛有湿润的KI粉末可以用来除去过量的氯气,尾气中含有有毒气体CH3Cl和过量的甲烷,容易污染空气,需要进行尾气处理,据此判断。
(1)MnO2能与HCl(浓)发生氧化还原反应生成MnCl2、Cl2和水,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)制备的氯气中含有水蒸气,可用浓硫酸除去,B装置的作用是干燥气体、使气体混合均匀、通过观察气泡来控制气流速度。
(3)氯气能将碘化钾氧化为碘单质,湿润的KI可除去过量的氯气。
(4)由于上述过程中产生的HCl易导致大气污染,所以E的作用是吸收尾气,HCl极易溶于水易发生倒吸,所以E还可以防止倒吸,答案选C。
(5)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可通过分液分开。
(6)1 mol CH4生成等物质的量的4种取代产物,即0.25 mol CH3Cl、0.25 mol CH2Cl2、0.25 mol CHCl3、0.25 mol CCl4,则所需n(Cl2)=0.25 mol×1+0.25 mol×2+0.25 mol×3+0.25 mol×4=2.5 mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列描述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.40gNaOH溶解在1L水中,所制得的溶液,物质的量浓度为1molL﹣1
C.标准状况下,11.2L四氯化碳所含分子数为0.5NA
D.常温常压下,5.6g铁与过量的盐酸反应转移电子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,设计成分分析方案如下,下列分析不正确的是( )
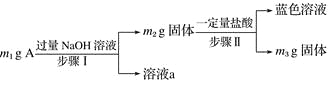
A. 当m1>m2时,溶液a中阴离子只有1种
B. 生成蓝色溶液的离子方程式涉Cu+2Fe3+===Cu2++2Fe2+
C. 要确定混合物中是否含Al,可取A加入适量稀HCl
D. 当m2-m3=2.96 g,Fe3O4的质量至少为2.32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B. 一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积
C. 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减小,则y>4;否则y<4
D. 相同质量的烃,完全燃烧,消耗O2越多,烃中含H量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示小麦开花数天后测定种子中主要物质的变化,请据图回答下列问题:

(1)成熟小麦种子中主要的营养物质是________。
(2)检测还原糖的试剂是________,还原糖的多少可通过________来判断。
(3)小麦种子成熟过程中,胚乳里蔗糖与还原糖含量比较,两者的变化趋势________________(填“相同”或“不同”)。
(4)种子成熟时,淀粉的形成与一种磷酸化酶的活性有密切关系,为验证磷酸化酶是否是蛋白质,实验过程中实验组试管加入________,对照组试管中加入2 mL豆浆,然后加入等量的________,如果均出现________现象,则证明磷酸化酶是蛋白质。
(5)播种等量的小麦种子和花生种子,________种子需要浅播,因为该种子中_______化合物含量多,该化合物元素组成特点是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
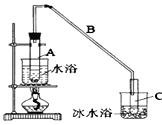
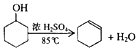
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知:
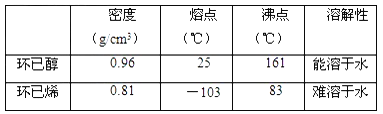
(1)制备粗品:
将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是_____________________________________。
②试管C置于冰水浴中的目的是_____________________________________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填上或下),分液后用________(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②将分液得到的环己烯再进行蒸馏,收集产品时,控制的温度应在_______左右。
(3)以下区分环己烯精品和粗品的方法,合理的是___________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是
A. 两种气体A与B的相对分子质量之比为m∶n
B. 同质量气体A与B的分子数之比为n∶m
C. 同温同压下,A、B两气体的密度之比为n∶m
D. 相同状况下,同体积A、B两气体的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是
A.64g二氧化硫中的氧原子数和标准状况下22.4L二氧化碳中的氧原子数
B.200mL1mol/L氯化钙溶液中c(Cl-)和100mL1mol/L氯化钾溶液中c(Cl-)
C.2mol水的摩尔质量和1mol水的摩尔质量
D.20%氢氧化钠溶液中氢氧化钠物质的量浓度和10%氢氧化钠溶液中氢氧化钠物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是__________。
A 溶液中导电粒子的数目减少 B 醋酸的电离程度增大,c(H+)亦增大
C 溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]不变 D 溶液中c(CH3COO-)/c(H+)减小
(2)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=_____________(溶液体积变化忽略不计)。
(3)常温下,浓度均为0.lmol/L的下列五种溶液的pH值如表所示:
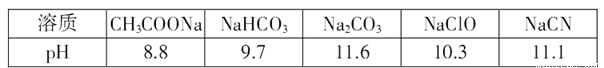
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是_____
A HCN B HClO C H2CO3 D CH3COOH
②根据以上数据,判断下列反应可以成立的是________。
A CH3COOH+Na2CO3=NaHCO3+CH3COONa B CH3COOH+NaCN=HCN+CH3COONa
C CO2 +H2O+ 2NaClO=Na2CO3+2HClO D NaHCO3+HCN=NaCN+CO2 +H2O
(4)几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度离子Cu2+、Fe2+、Mg2+的溶液中滴加NaOH溶液时,_________(填离子符号)先沉淀。
(5)电解质水溶液中存在电离平衡、水解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是__________;
②体积相同、c(H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com