
【题目】石油裂解气是重要的化工原料,以裂解气为原料合成有机物X(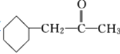 )的流程如图:
)的流程如图:
A(CH2=CHCH3) ![]() B(CH2=CHCH2Cl)
B(CH2=CHCH2Cl)![]() D(
D(![]() )
)![]() E
E![]() F(
F(![]() )
)![]() G(
G(![]() )
)![]()
![]() X(
X(![]() )
)
请回答下列问题:
(1)反应①的反应类型是____________。
(2)B的名称是____________,D分子中含有官能团的名称是____________。
(3)写出物质C的结构简式:____________。
(4)写出A生成B的化学方程式:____________。写出反应③的化学方程式:____________。
(5)满足以下条件D的同分异构体有____________种。
①与D有相同的官能团;②含有六元环;③六元环上有2个取代基。
(6) 参照F的合成路线, 设计一条由CH3CH=CHCH3制备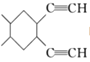 的合成线路(其他试剂任选)__________。
的合成线路(其他试剂任选)__________。
【答案】加成反应 3氯丙烯 碳碳双键和氯原子 CH2=CHCH=CH2 CH2=CHCH3 + Cl2![]() CH2=CHCH2Cl + HCl
CH2=CHCH2Cl + HCl ![]() 20
20 ![]()
【解析】
根据各物质的转化关系,丙烯与氯气发生取代生成B为3-氯丙烯,比较B和D的结构简式可知,B与C发生加成反应生成D,C为CH2=CHCH=CH2,D与氢气发生加成反应生成E为![]() ,E与氰化钠发生取代生成F,F与氢气加成生成G,G与氯化氢加成再碱性水解得
,E与氰化钠发生取代生成F,F与氢气加成生成G,G与氯化氢加成再碱性水解得![]() ,
,![]() 再氧化可得X,以CH3CH=CHCH3合成
再氧化可得X,以CH3CH=CHCH3合成![]() ,可以用CH3CH=CHCH3与CH2=CHCH=CH2发生加成反应得
,可以用CH3CH=CHCH3与CH2=CHCH=CH2发生加成反应得![]() ,
,![]() 再与氯气加成后与乙炔钠反应可得
再与氯气加成后与乙炔钠反应可得![]() ,据此答题。
,据此答题。
(1)根据上面的分析可知,反应①的反应类型是加成反应,故答案为:加成反应。
(2)B的名称是3氯丙烯,根据D的结构简式可知,D分子中含有官能团的名称是碳碳双键和氯原子,故答案为:3氯丙烯;碳碳双键和氯原子。
(3)根据上面的分析可知,物质C的结构简式为CH2=CHCH=CH2,故答案为:CH2=CHCH=CH2。
(4)A生成B的化学方程式为CH2=CHCH3 + Cl2![]() CH2=CHCH2Cl + HCl,应③的化学方程式为
CH2=CHCH2Cl + HCl,应③的化学方程式为![]() ;故答案为:CH2=CHCH3 + Cl2
;故答案为:CH2=CHCH3 + Cl2![]() CH2=CHCH2Cl + HCl;
CH2=CHCH2Cl + HCl;![]() 。
。
(5)根据D的结构,结合条件①有相同的官能团,即有碳碳双键和氯原子,②含有六元环,③六元环上有2个取代基,则符合条件的D的同分异构体为含有碳碳双键的六元环上连有氯原子和甲基,这样的结构有17种,或者是![]() 的环上连有氯原子,有3种结构,所以共有20种;故答案为:20。
的环上连有氯原子,有3种结构,所以共有20种;故答案为:20。
(6)以CH3CH=CHCH3合成![]() ,可以用C CH3CH=CHCH3与CH2=CHCH=CH2发生加成反应得
,可以用C CH3CH=CHCH3与CH2=CHCH=CH2发生加成反应得![]() ,
,![]() 再与氯气加成后与乙炔钠反应可得
再与氯气加成后与乙炔钠反应可得![]() ,反应的合成路线为
,反应的合成路线为![]() ;故答案为:
;故答案为:![]() 。
。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:
【题目】某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
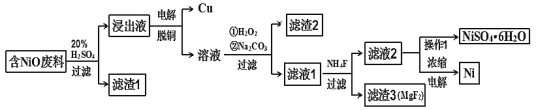
已知:有关金属离子生成氢氧化物沉淀所需的pH如图:

(1)滤渣1的主要成分为____。
(2)①用离子方程式解释加入H2O2的作用____。
②加Na2CO3调节溶液的pH至5,则滤渣2的主要成分为____。
(3)从滤液2中获得NiSO4·6H2O的实验操作是____、过滤、洗涤、干燥。
(4)电解浓缩后的滤液2可获得金属镍,其基本反应原理示意图如图:
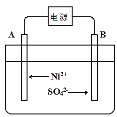
①B极附近pH会____(填“增大”、“减小”或“不变”);用平衡移动原理解释B极附近pH变化的原因:____。
②一段时间后,在A、B两极均收集到11.2L气体(标准状况下),理论上能得到Ni____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某无机化合物的二聚分子,该分子中A、B两种元素都只有3个能层,分子中所有原子的最外层都达到8个电子的稳定结构。下列说法不正确的是
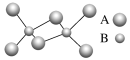
A.元素A位于元素周期表第三周期第ⅢA族
B.该化合物是共价化合物,在熔融状态下能导电
C.该化合物在固态时所形成的晶体是分子晶体
D.该化合物中存在极性共价键,无非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的轨道表示式为_________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是____________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___________。
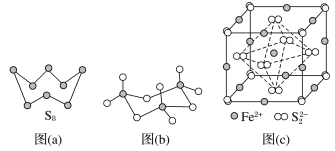
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为____________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为2 mol·L-1B.上述电解过程中共转移2 mol电子
C.电解得到的Cu的物质的量为0.5 molD.电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断正确的是
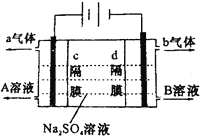
A.a气体为氢气,b气体为氧气
B.A溶液为氢氧化钠,B溶液为硫酸
C.c隔膜为阳离子交换膜、d隔膜为阴离子交换膜
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O![]() 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M对霉菌有较好的抑制作用,结构简式为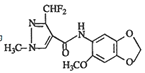 ,其合成路线如图所示:
,其合成路线如图所示:
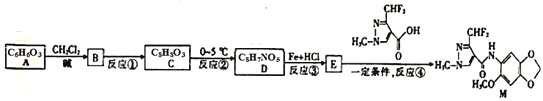
已知: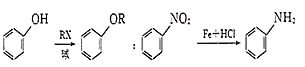
回答下列问题:
(1)化合物B的分子式为___;D中官能团的名称为__。
(2)反应②的反应类型是__。
(3)化合物E的结构简式为___。
(4)写出A与足量溴水反应的化学方程式:__。
(5)写出符合下列条件的D的同分异构体__(填结构简式,写出一种即可)。
①含有硝基和羰基,且分别和苯环直接相连;
②能与FeCl3溶液发生显色反应;
③核磁共振氢谱显示有3组峰,且峰面积之比为2:2:3。
(6)请以![]() 、
、![]() 为原料合成化合物
为原料合成化合物![]() ,写出制备的合成路线流程图。(无机试剂任用)__。
,写出制备的合成路线流程图。(无机试剂任用)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种高能燃料,也广范应用在工业合成中。
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1 mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
③2H2(g)+02(g)=2H2O(l),△H=-571.6 kJ·mol-1
写出乙烷标准生成焓的热化学方程式:_____________。
(2)已知合成氨的反应为:N2+3H2![]() 2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:

①图中代表反应在恒容绝热容器中进行的曲线是______(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=__________________。
③b容器中M点,v(正)_____ v(逆)(填“大于”、“小于”.或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为_____;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为_______。
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s)![]() Cu2++2OH- Ksp=2.2×10-20
Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3·H2O![]() [Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3·H2O![]() [Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
[Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
②已知反应Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
[Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com