解答:
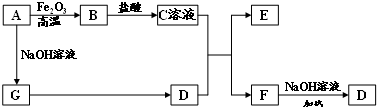
解:D是能使湿润的红色石蕊试纸变蓝色的气体,则D为NH
3,其中A、G为单质,且A与氧化铁反应,与氢氧化钠反应反应得到G,G反应可以得到氨气,可推知A为Al、G为H
2,E、F均能与NaOH溶液反应,结合转化关系可知,故B为Al
2O
3,C为AlCl
3,E为Al(OH)
3,F为NH
4Cl,
(1)F为NH
4Cl,电子式为:
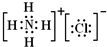
,故答案为:
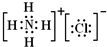
;
(2)①C溶液与D反应的离子方程式为:Al
3++3NH
3?H
2O=Al(OH)
3↓+3NH
4+,
故答案为:Al
3++3NH
3?H
2O=Al(OH)
3↓+3NH
4+;
②F溶液与NaOH溶液共热反应的化学方程式为:NH
4Cl+NaOH
NaCl+NH
3↑+H
2O,
故答案为:NH
4Cl+NaOH
NaCl+NH
3↑+H
2O;
(3)①AlCl
3溶液中铝离子水解:Al
3++3H
2O?Al(OH)
3+3H
+,平衡水的电离平衡,溶液呈酸性,
故答案为:Al
3++3H
2O?Al(OH)
3+3H
+;
②NH
4Cl溶液中铵根离子水解,溶液呈酸性,故溶液中离子浓度由大到小的顺序为:c(Cl
-)>c(NH
4+)>c(H
+)>c(OH
-),
故答案为:c(Cl
-)>c(NH
4+)>c(H
+)>c(OH
-);
(4)将5.4g Al的物质的量=
=0.2mol,200mL 2.0mol/L某溶液中溶质的物质的量=0.2L×2mol/L=0.4mol,将Al投入该溶液中有G单质产生,且充分反应后有金属剩余,Al与稀硝酸反应没有气体单质生成,与稀硫酸、氢氧化钠、盐酸反应都生成氢气,
由2Al~3H
2SO
4可知,0.2molAl完全反应消耗H
2SO
4 的物质的量=0.3mol<0.4mol,故Al没有剩余,
由2Al~2NaOH可知,0.2molAl完全反应消耗NaOH的物质的量=0.2mol<0.4mol,故Al没有剩余,
由2Al~6HCl可知,0.2molAl完全反应消耗HCl的物质的量=0.6mol>0.4mol,故Al有剩余,
故答案为:D;
(5)将1molN
2和3molH
2和及催化剂充入容积为2L的某密闭容器中进行反应,已知该反应为放热反应.平衡时,测得NH
3的物质的量浓度为a mol/L,
①如果反应速率v(H
2)=1.2mol/(L?min),则v(NH
3)=
v(H
2)=
×1.2mol/(L?min)=0.8mol/(L?min),故答案为:0.8;
②在其他条件不变的情况下,若起始时充入0.5molN
2和1.5molH
2达到平衡等效为在原平衡基础上体积扩大一倍,压强减小,平衡向生成氮气、氢气的方向移动,故NH
3的物质的量浓度小于0.5amol/L,故答案为:小于;
③N
2(g)+3H
2(g)?2NH
3(g)
开始(mol/L):0.5 1.5 0
变化(mol/L):0.5a 1.5a a
平衡(mol/L):0.5(1-a) 1.5(1-a) a
故该温度下平衡常数k=
,
故答案为:
.

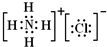 ,故答案为:
,故答案为: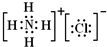 ;
;

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 金属及其化合物在生产、生活中有广泛应用.
金属及其化合物在生产、生活中有广泛应用.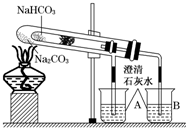 “套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验.因其有许多优点,近年来被广泛开发并应用于化学实验中.下面这个实验为“套管实验”,实验装置中,小试管中部有沾上无水硫酸铜粉末的脱脂棉.请观察实验装置,分析实验原理,并回答下列问题:
“套管实验”是将一支较小的试管装入另一试管中,经组装来完成原来需要两只或更多试管进行的实验.因其有许多优点,近年来被广泛开发并应用于化学实验中.下面这个实验为“套管实验”,实验装置中,小试管中部有沾上无水硫酸铜粉末的脱脂棉.请观察实验装置,分析实验原理,并回答下列问题: