
【题目】某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答: 
(1)写出选用物质的名称:A , B , C
(2)烧瓶中反应的离子方程式为 ,
(3)根据图2回答:
乙同学的实验原理是 ,
(4)B处的实验现象是;
(5)B处的反应的离子方程式: .
(6)有同学认为甲同学的实验设计有明显的不足,你认为不足之处为 .
【答案】
(1)稀硝酸;碳酸钙;硅酸钠溶液
(2)CaCO3+2H+═Ca2++CO2↑+H2O
(3)强氧化剂生成弱氧化剂或活泼的非金属单质置换不活泼的非金属单质
(4)湿润的淀粉KI试纸变蓝
(5)2I﹣+Cl2═2Cl﹣+I2
(6)反应中硝酸具有挥发性,可能是挥发出的硝酸溶于水与硅酸钠反应生成硅酸沉淀
【解析】解:(1)要比较碳和硅两种元素的非金属强弱,可以通过其最高价氧化物对应水合物的酸性强弱来判断,即可用较强酸制备较弱酸,因此可考虑把CO2气体通入Na2SiO3溶液,看是否有硅酸沉淀生成.观察图1,B为颗粒状固体,则可判断B为CaCO3 , 应用硝酸(不用硫酸,因为硫酸无法与碳酸钙反应制取二氧化碳)与碳酸钙反应制取CO2 . 则A是硝酸,B是碳酸钙,C是硅酸钠溶液.所以答案是:硝酸;碳酸钙;硅酸钠溶液;
(2.)烧瓶中应是碳酸钙与稀硝酸反应,因为碳酸钙难溶于水,要写分子式,硝酸是强酸,要写成离子,因此烧瓶中反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.烧所以答案是:CaCO3+2H+=Ca2++CO2↑+H2O;
(3.)由图2,根据题意,浓盐酸与高锰酸钾反应会生成氯气,然后氯气经过B处会与KI反应生成I2 , 由此可知,验证卤族元素性质的递变规律的实验原理是:强氧化剂生成弱氧化剂 或活泼的非金属单质置换出较不活泼的非金属单质,所以答案是:强氧化剂生成弱氧化剂或活泼的非金属单质置换不活泼的非金属单质;
(4.)氯气在B处与KI反应生成单质碘,碘单质与淀粉作用会变成蓝色,即B处的实验现象是:湿润的淀粉KI试纸变蓝,所以答案是:湿润的淀粉KI试纸变蓝;
(5.)B处氯气与KI反应的化学方程式是:Cl2+2KI═2Cl﹣+I2 , 其离子方程式是:2I﹣+Cl2I2+2Cl﹣ . 所以答案是:2I﹣+Cl2I2+2Cl﹣;
(6.)B中硝酸与碳酸钙反应,由于反应中硝酸具有挥发性,可能是挥发出的硝酸溶于水与硅酸钠反应生成硅酸沉淀,所以会对二氧化碳与硅酸钠的反应产生干扰;
所以答案是:反应中硝酸具有挥发性,可能是挥发出的硝酸溶于水与硅酸钠反应生成硅酸沉淀.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列气体通入溶液中一定不会出现浑浊的是
A.CO2通入Ca(OH)2溶液中B.SO2通入Ba(NO3)2溶液中
C.SO2通入BaCl2溶液中D.Cl2通入氢硫酸溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片和稀硫酸反应制取H2时,下列措施不能使氢气的生成速率增大的是( )。
A.加热
B.不用稀硫酸,而改用98%的浓硫酸
C.滴加少量浓盐酸
D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解CuSO4溶液,当铜离子浓度降至一半时,停止通电,若使CuSO4溶液恢复到原浓度,应加入的物质是
A. CuO B. H2O C. CuSO4 D. Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:
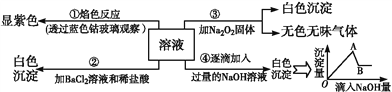
请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________。
(3)写出实验④中A点对应沉淀的化学式:__________。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.高铁酸钾(K2FeO4)具有很强的氧化性,在生产,生活中有广泛应用。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是_____。
(2)制备K2FeO4可以采用湿式氧化法,流程如图:
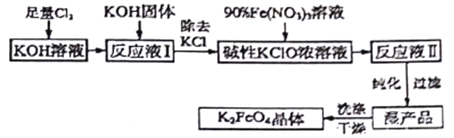
己知:① 温度较低时,Cl2通入KOH溶液生成次氯酸盐;温度较高时,Cl2通入KOH溶液生成氯酸盐;② Fe(NO3)3溶液与KClO溶液在强碱性环境中生成K2FeO4。请回答下列问题:
① 该生产工艺应在_____(填“温度较高”或“温度较低”)的情况下进行。
② 写出产生K2FeO4的离子方程式_________。
(3)实验室模拟工业电解法制取K2FeO4,装置如图.

①此装置中电源的负极是______(填“a”或“b”).
②阳极的电极反应式为______.
II.常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因_____________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)_____(填“>”、“<”或“=”)0.1mol/LNaOH溶液中由水电离出的c(H+)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有碘离子,某化学兴趣小组设计如下的步骤从海带中提取单质碘:( )
①通足量氯气②将海带烧成灰,向灰中加水搅拌 ③加CCl4振荡
④过滤 ⑤用分液漏斗分液。合理的操作顺序为
A. ①→③→⑤→②→④ B. ②→①→③→④→⑤
C. ②→④→①→③→⑤ D. ③→①→②→⑤→④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com