
(13分)某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
(13分)
(1)2Fe2++H2O2+2H+=2Fe3++2H2O(2分) (2)C(2分)
(3)Fe(OH)3+3HF=FeF3+3H2O(2分) (4)通风橱(或密闭容器)(2分)
(5)FeF3+3Li=Fe+3LiF(2分) (6)Fe4O5(或2FeO?Fe2O3)(3分)
【解析】
试题分析:(1)H2O2把Fe2+氧化为Fe3+,在酸性条件下的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)步骤②加入了过量的氢氟酸溶液,玻璃和陶瓷中含有二氧化硅,而二氧化硅能与氢氟酸反应,所以A、B项错误,故C项正确。
(3)沉淀为Fe(OH)3,加入氢氟酸发生酸碱中和反应,化学方程式为:Fe(OH)3+3HF=FeF3+3H2O
(4)反应过程中,挥发出腐蚀性气体HF,所以从安全的角度考虑,在实验室里制三氟化铁时应在通风橱(或密闭容器)中进行。
(5)Li的活泼性大于Fe,所以三氟化铁与Li发生置换反应的化学方程式为:FeF3+3Li=Fe+3LiF
(6)Cl2的物质的量为0.672L÷22.4L/mol=0.03mol,Cl2氧化Fe2+为Fe3+,根据电子转移守恒可知Fe2+的物质的量为0.03mol×2=0.06mol,故氧化物中+2价铁的物质的量为0.06mol,最后所得为氯化铁溶液,蒸干溶液,灼烧至恒重,得9.6g固体为Fe2O3,Fe2O3的物质的量为9.6g÷160g/mol=0.06mol,利用铁元素守恒可知氧化物中+3价铁的物质的量为0.06mol×2-0.06mol=0.06mol,所以铁氧体样品含Fe2O3的物质的量为:0.03mol,所以该铁氧体的化学式为Fe4O5(或2FeO?Fe2O3)
考点:本题考查物质制备方案的分析、化学方程式和离子方程式的书写、混合物的计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:选择题
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
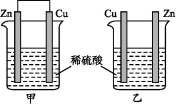
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱 D.产生气泡的速率甲比乙慢
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:选择题
在1L密闭容器发生反应:4NH3(g)+5O2(g) 4NO(g)+6HO(g) △H=-Q kJ· mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
4NO(g)+6HO(g) △H=-Q kJ· mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
时间/浓度 | c(NH3)( mol·L-1) | c(O2)( mol·L-1) | c(NO)( mol·L-1) |
起始 | 0.8 | 1.6 | 0 |
第2min | 0.6 | a | 0.2 |
第4min | 0.3 | 0.975 | 0.5 |
第6min | 0.3 | 0.975 | 0.5 |
第8min | 0.7 | 1.475 | 0.1 |
第10min | 0.7 | 1.475 | 0.1 |
下列说法错误的是
A.反应在第2min到第4min时,O2的平均速率为0.1875 mol·L-1·min-1
B.反应在第2min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4min、第8min时分别达到化学平衡,且平衡常数相同
D.在开始反应的前2min内,该反应放出0.05QKJ的热量
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4L的H2O所含的分子数为NA
B.1mol T2O分子所含的中子数为10NA
C.常温常压下,20g D2O分子中所含的质子数为10NA
D.1mol H3O+所含的电子数为11NA
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉市高三四月调考理综化学试卷(解析版) 题型:简答题
(15分)

(1) A的名称为____
(2) G中含氧官能团名称为____
(3) D的分子中含有____种不同化学环境的氢原子
(4) E与新制的氢氧化铜反应的化学方程式为____
(5)写出符合下列条件的A的所有同分异构体的结构简式:____
A.分子中有6个碳原子在一条直线上:b.分子中含--OH
(6)正戊醇可用作香料、橡胶促进剂等,写出以乙醇为原料制备 的合成路线流
的合成路线流
程图(无机试剂任用)。合成路线流程示意图示例如下:

查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:填空题
(10分).
Ⅰ.下表列出了A~R 9种元素在周期表中的位置(填元素符号):
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
| E |
| F |
|
|
3 | A | C | D |
|
|
| G | R |
4 | B |
|
|
|
|
| H |
|
(1)这9种元素中化学性质最不活泼的是__________,
(2)A、B、C三种元素按原子半径由大到小的顺序排列为
(3)F元素氢化物的化学式是
(4)G元素跟B元素形成化合物的电子式是
(5)G元素和H元素两者核电荷数之差是
Ⅱ根据原子结构的有关知识和元素周期律。思考并回答有关114号元素的几个问题。
原子核外有_____个电子层,最外层电子数可能是__________
周期表中位于__________周期,________族
(3) 属于_________元素(填金属或非金属)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省宜昌市高三5月模拟理综化学试卷(解析版) 题型:填空题
【化学–选修5:有机化学基础】(15分)
我国湖南、广西等地盛产的山苍子油中柠檬醛含量很高,质量分数可达到60%-90%,柠檬醛也可以利用异戊二烯为原料人工合成,柠檬醛又可用来合成紫罗兰酮等香精香料,其合成路线如下:
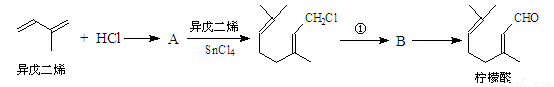
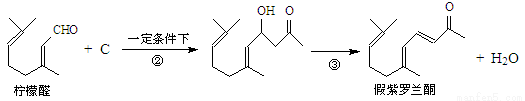
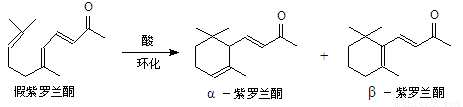
已知:①
②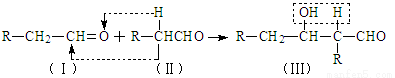
③同一碳原子连有两个双键结构不稳定。
试根据上述转化关系回答下列问题:
(1)写出A的结构简式 ,C的结构简式 。
(2)①对应的反应条件是 ,反应③的反应类型是 。
(3)写出B转化为柠檬醛的化学方程式 。
(4)根据反应②的反应机理写出CH3CHO与足量的HCHO反应产物的结构简式:
。
(5)检验柠檬醛中含有碳碳双键的实验方法是: 。

 (6)α-紫罗兰酮、β-紫罗兰酮有很多同分异构体,则满足下列条件的同分异构体有 种。
(6)α-紫罗兰酮、β-紫罗兰酮有很多同分异构体,则满足下列条件的同分异构体有 种。
①含有一个苯环 ②属于醇类且不能发生催化氧化反应
③核磁共振氢谱显示有5个峰
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省四校下学期期中考试高一化学试卷(解析版) 题型:选择题
卤素间形成的化合物如“IF5、BrCl、IBr”等称为卤素互化物,化学性质与卤素单质类似,则下列关于卤素互化物的性质的描述及发生的相关反应不正确的是
A.IF5 + 3H2O = HIO3 +5HF
B.3IBr +2Fe = FeI3 + FeBr3
C.BrCl的氧化性强于I2
D.IBr可以与NaOH溶液反应生成2种盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com