
下列指定反应的离子方程式正确的是
A.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
D.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA
B.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D.标准状况下,22.4 L甲醇中含有的氧原子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各组物质的叙述,正确的是
① H2N—CH2—COOH和H3C—CH2—NO2 ② CH3COOH和HCOOCH3
③ CH3CH2CHO 和 CH3COCH3 ④ CH3CH2CH2OH和CH3CH2OCH3
⑤2—甲基丙烷和丁烷 ⑥CH3CH=CHCH2CH3和CH3CH2CH2CH=CH2
⑦CH3(CH2)4CH3 和 CH3CH(CH3)CH2CH3
A.①②③④⑤⑥⑦都是同分异构体 B.⑥是官能团异构类型
C.⑦是碳链异构类型 D.①②③④是官能团异构类型
查看答案和解析>>
科目:高中化学 来源: 题型:
请写出下列反应的化学方程式:
(1)实 验 室 制 取 乙 炔 的 化 学 方 程 式 是 。
(2)乙醇的催化氧化:
(3)写出由苯丙烯(  )在催化剂作用下生成聚苯丙烯的反
)在催化剂作用下生成聚苯丙烯的反
应方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O  Y+ H2 ;Z + H2O
Y+ H2 ;Z + H2O  W + O2 (方程式均未配平),可推断X、Y中及Z、W中相同元素的化合的高低顺序为
W + O2 (方程式均未配平),可推断X、Y中及Z、W中相同元素的化合的高低顺序为
A、X>Y、Z>W B、X<Y、Z<W
C、X>Y、Z<W D、X<Y、Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述I | 叙述II |
A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
B | Fe3+ 具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
C | 溶解度:CaCO3 < Ca(HCO3)2 | 溶解度:Na2CO3 < NaHCO3 |
D | SiO2 可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用_____________。
(3)Ⅲ中,生成FeCO3的离子方程式是_____________。若FeCO3浊液长时间暴露在空气中, 会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42-的操作是_____________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3, 得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。 (摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3, 得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。 (摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验处理不可行的是 ( )
 |
①.将 与NaOH的醇溶液共热制备CH3—CH═CH2
②.向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热——检验混合物中是否含有甲醛
③.向丙烯醛(CH2=CH—CHO)中滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
④.为验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再滴入几滴硝酸银溶液,观察现象
A.只有①③ B.只有①②④
C.只有②③④ D.都不能
查看答案和解析>>
科目:高中化学 来源: 题型:
磷单质及其化合物有广泛应用。
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来___________________________________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)====6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)====P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)====CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=_____________________________。
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见下图)之间脱去两个水分子的产物,其结构式为________________________。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为___________________________。
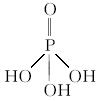
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为________________________。
②化学镀镍的溶液中含有Ni2+和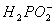 ,在酸性等条件下发生下述反应:
,在酸性等条件下发生下述反应:
(a)__________Ni2++______ ____
____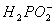 +__________
+__________ __________Ni+________
__________Ni+________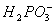 +_______
+_______
(b)6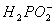 +2H+====2P+4
+2H+====2P+4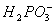 +3H2↑
+3H2↑
请在答题卡上写出并配平反应式(a)。
③利 用②中反应可在塑料镀件表面沉积镍磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
用②中反应可在塑料镀件表面沉积镍磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点:_______________;原理上的相同点:_______________;化学镀的优点:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com