
�������и������ʵ���������ȷ����
�� H2N��CH2��COOH��H3C��CH2��NO2 �� CH3COOH��HCOOCH3
�� CH3CH2CHO �� CH3COCH3 �� CH3CH2CH2OH��CH3CH2OCH3
��2��������Ͷ��� ��CH3CH=CHCH2CH3��CH3CH2CH2CH=CH2
��CH3(CH2)4CH3 �� CH3CH(CH3)CH2CH3
A���٢ڢۢܢݢޢ߶���ͬ���칹�� B�����ǹ������칹����
C������̼���칹���� D���٢ڢۢ��ǹ������칹����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
NA��������٤����������֪C2H4��C3H6�Ļ���������Ϊag����û����
A.�������õ��Ӷ���ĿΪ��a/7+1��NA B.����̼�����ĿΪaNA/7
C.ȼ��ʱ���ĵ�O2һ����33.6a /14L D.����ԭ������ΪaNA/14
/14L D.����ԭ������ΪaNA/14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ����
A 48gO3���庬��6.02��1023��O3����
B ���³�ѹ�£�4.6gNO2���庬��1.81��1023��NO2����
C 0.5mol��L��1CuCl2��Һ�к���3.01��1023��Cu2+
D ��״���£�33.6LH2O����9.03��1023��H2O����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ӵ�����ԼΪ6.02��1023 mol��1��������������ȷ����
A.���³�ѹ�£�18.0g ��ˮ��D2O�������ĵ�����ԼΪ10��6.02��1023
B.�����£�42.0g��ϩ�ͱ�ϩ�Ļ�������к��е�̼ԭ����Լ Ϊ3��6.02��1023
Ϊ3��6.02��1023
C.��״���£�22.4L �ױ������ķ�����ԼΪ6.02��1023
D.��״���£�a L ����������������еķ�����ԼΪ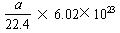
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
1���ij��̬����2����Ȼ��ⷢ���ӳɷ�Ӧ�����ܺ�6���������
��ȡ����Ӧ���ɴ˿��Զ϶�ԭ��̬���ǣ��������������ͬ�����²ⶨ��
A����Ȳ B����Ȳ C����Ȳ D������ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��ϩ������ƽ���νṹ����ˣ�1,2��������ϩ�����γ�

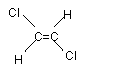 |
�� ���ֲ�ͬ�Ŀռ��칹�塣���и������У����γ���������
���ֿռ��칹�����
A��1����ϩ���������������� B��2����ϩ
C��2������2����ϩ�������������� D����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ָ����Ӧ�����ӷ���ʽ��ȷ����
A��Cu����ϡ����HNO3��Cu��2H����NO3��=Cu2����NO2����H2O
B��(NH4)2Fe(SO4)2��Һ�����NaOH��Һ��Ӧ��Fe(OH)2��Fe2����2OH��=Fe(OH)2��
C����NaAlO2��Һ��ͨ�����CO2��Al(OH)3��CO2��AlO2����2H2O=Al(OH)3����HCO3��
D����CH3COOH�ܽ�CaCO3��CaCO3��2H��=Ca2����H2O��CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪����1��Zn��s��+1/2O2��g��==ZnO(s)����H=-348.3kJ/mol
(2) 2Ag(s)+1/2 O2��g��== Ag2O(s)����H=-31.0kJ/mol
��Zn��s��+ Ag2O(s)== ZnO(s)+ 2Ag(s)�Ħ�H����
A.-317.3kJ/mol B. -379.3kJ/mol
-379.3kJ/mol
C.-332.8 kJ/mol D.317.3 kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com