
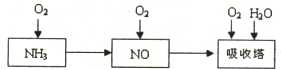
 工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
| ||
| △ |
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| ||
| △ |
| ||
| 5min |
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| 0.42 |
| 0.6×0.63 |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
| A、用稀硝酸与铁反应制取氢气 |
| B、用酒精萃取碘水中的碘 |
| C、用盐酸鉴别苏打和食盐 |
| D、用氢氧化钠溶液与可溶性铝盐制备氢氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .
.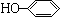 )的电离平衡常数K2的相对大小
)的电离平衡常数K2的相对大小
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
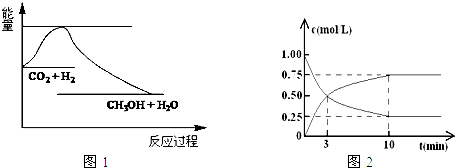
查看答案和解析>>
科目:高中化学 来源: 题型:
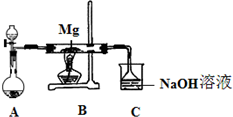 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
| ||
| ||
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后所得固体于试管中 | |
| ② | 向试管中的固体慢慢滴加 试管口塞上带导管的单孔塞,并将导管通入盛有 |
若试管中的 则丙同学推测正确. 若试管中的固体未完全溶解,且 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com