
| A、用稀硝酸与铁反应制取氢气 |
| B、用酒精萃取碘水中的碘 |
| C、用盐酸鉴别苏打和食盐 |
| D、用氢氧化钠溶液与可溶性铝盐制备氢氧化铝 |


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
| A、将体积减小至原来的一半 |
| B、加入催化剂 |
| C、将反应温度升高至1 000℃ |
| D、增大水蒸气的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K越大,达到平衡时,反应进行的程度越大 |
| B、K的表达式是K=Cp(C)?Cq(D)/Cm(A)?Cn(B) |
| C、若Qc>K,则反应向逆反应方向进行 |
| D、正、逆反应的平衡常数数值相同,符号相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温时,可与Al反应生成大量H2 |
| B、将浓硫酸置于敞口容器中,经过一段时间质量将减少 |
| C、稀释浓硫酸时,应将其沿着器壁慢慢加入到水中,并用玻璃棒不断搅拌 |
| D、硫酸是强酸,所以通常用浓硫酸与大理石反应制取二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X原子最外层有5个电子 |
| B、当有1mol X2生成时,共有2mol电子转移 |
| C、氧化产物和还原产物的物质的量之比为5:1 |
| D、“( )”所填的微粒和XO3-在任何环境下都不能共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与溶液的物质的量浓度有关 |
| B、只与温度有关,而与浓度无关 |
| C、根据相同条件下K的大小,可以判断弱酸的相对强弱 |
| D、升高温度K增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
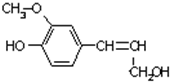 木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法错误的是( )
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法错误的是( )| A、该物质的分子式是C10H12O3,属于芳香烃 |
| B、该物质可以与FeCl3溶液发生显色反应,也能发生酯化反应 |
| C、1mol该物质最多能消耗4mol H2 |
| D、1mol该物质与溴水发生反应,可消耗4mol Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
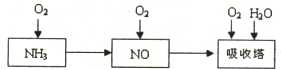 工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com