
25℃时,下列说法正确的是( )
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl—)>c(NH4+) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3—) >c(H2CO3)>c(CO32?) |
| C.pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后所得溶液显酸性 |
| D.将0.1 mol/L的氨水溶液加水稀释10倍,溶液中离子浓度都减少 |
BC
解析试题分析:A.根据溶液呈电中性原则,c(H+)+ c(NH4+) = c(Cl—)+c(OH-).由于溶液显中性, c(H+)=c(OH-)所以c(Cl—)=c(NH4+) 。错误B.NaHCO3溶液的pH=8.3,说明HCO3—的水解作用大于其电离作用。因此c(H2CO3)>c(CO32?)。根据物料守恒可得c(Na+)= c(HCO3—) +c(H2CO3)+c(CO32?)。因此c(Na+)>c(HCO3—) 。所以c(Na+)>c(HCO3—) >c(H2CO3)>c(CO32?)。正确。C.NaOH是强碱,pH=12的NaOH溶液c(NaOH)= c(OH-)=10-2mol/L; 醋酸是弱酸,部分电离,pH=2的醋酸溶液c(CH3COOH)> c(H+)=10-2mol/L.当二者等体积混合时,由于n(CH3COOH)>n(NaOH),所以混合后所得溶液显酸性。正确。D.将0.1 mol/L的氨水溶液加水稀释10倍,NH3·H2O电离产生的离子的浓度都减小,电离平衡NH3·H2O NH4++ OH-正向移动,使NH4+和 OH-又略有增大,但是总的来说离子的浓度还减小。由于在溶液中存在水的电离平衡c(H+)·c(OH-)=Kw.由于c(OH-)减小,所以c(H+)增大。错误。
NH4++ OH-正向移动,使NH4+和 OH-又略有增大,但是总的来说离子的浓度还减小。由于在溶液中存在水的电离平衡c(H+)·c(OH-)=Kw.由于c(OH-)减小,所以c(H+)增大。错误。
考点:考查溶液中离子浓度的大小比较的知识。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:单选题
25℃时,已知弱酸的电离常数:K(CH3COOH) =" 1.8" ×10-5;K1(H2CO3) =" 4.4" ×10-7;K2(H2CO3) =" 4.7" × 10-11;K(HClO) =" 4.0" ×10-8。则下列说法正确的是
| A.新制氯水与碳酸氢钠不反应 |
| B.25℃时,0.1mol/L的醋酸溶液与0.01mol/L的醋酸溶液中,Ka前者小于后者 |
| C.NaClO溶液中通入少量二氧化碳的反应为:2NaClO+CO2+ H2O = Na2CO3 +2HClO |
| D.等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
人体血液中存在平衡:CO2 + H2O  H2CO3
H2CO3  HCO3—,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。已知pH随c(HCO3—)︰c(H2CO3) 变化关系如下表所示,则下列说法中不正确的是
HCO3—,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。已知pH随c(HCO3—)︰c(H2CO3) 变化关系如下表所示,则下列说法中不正确的是
| c(HCO3—):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
| A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
 Na2CO3 + 2HClO
Na2CO3 + 2HClO NaCN+ NaHCO3
NaCN+ NaHCO3查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液发生反应的离子方程式为Al3++3OH- Al(OH)3↓ Al(OH)3↓ |
| B.其溶液的pH=13 |
| C.用适量水稀释后,NH3·H2O电离度和溶液pH都增大 |
| D.加水稀释后,溶液中c(NH4 +)·c(OH-)变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在20 mL 0.1mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是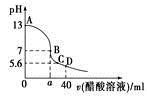
| A.溶液??性时,回滴加入适量的NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| B.C点时其pH=5.6,溶质恰好为等物质的量CH3COONa和CH3COOH,则溶液中微粒浓度关系为:c(Na+)>c(CH3COO-) |
| C.在B点,a>20,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| D.在D点:c(CH3COOH)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液中微粒浓度关系一定正确的是
A 均为0.10mol·L-1 NH4Cl和NH4HSO4溶液,c(NH4+)前者小于后者
B 25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW
C 25℃时pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者
D. 25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH< 7
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
| B.溶液中c(CH3COO-)/[c(CH3COOH)··c(OH-)]不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com