
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源:不详 题型:填空题

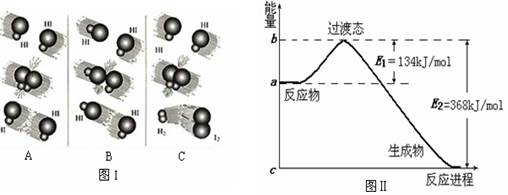
 (1)图中E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
(1)图中E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?  (2)已知单质硫16g燃烧放热为149 KJ写出硫燃烧热的热化学方程式:
(2)已知单质硫16g燃烧放热为149 KJ写出硫燃烧热的热化学方程式:  (3)
(3)
 计算由S(s)生成3 molSO3(g)的△H
计算由S(s)生成3 molSO3(g)的△H 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
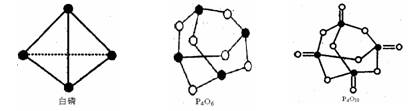
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/ kJ·mol–1 | 198 | 360 | 498 | X |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
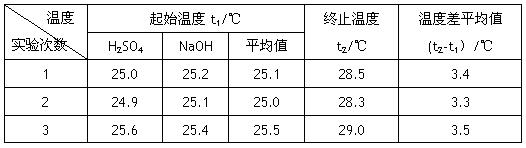
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
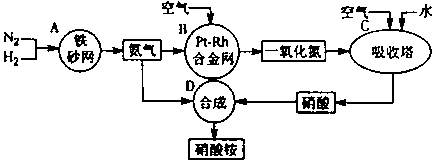
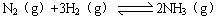 △H= —92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
△H= —92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.使用环形玻璃棒是为了加快反应速率,减小实验误差 |
| B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 |
| C.用0.5mol·L-1NaOH溶液分别与0.5 mol·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 |
| D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
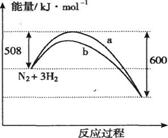
A.该反应的热化学方程式为:N2+3H2 2NH3△H=-92kJ·mol-1 2NH3△H=-92kJ·mol-1 |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热不变 |
| D.在相同温度的条件下,在体积相同I、II两个容器中分别通入1mol N2和3 mol H2,容器I体积恒定,容器II体积可变保持恒压,则反应过程中两容器内的反应速率V(I)<V(II) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应速率总是大于吸热反应速率 |
| C.形成离子键的阴、阳离子间只存在静电吸引力 |
| D.元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com