
| A.用纯锌与稀硫酸反应 | B.用纯锌与稀硝酸反应 |
| C.用粗锌与稀硝酸反应 | D.在CuSO4溶液中浸泡过的纯锌与稀硫酸反应。 |
科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3 | B.CH3COONa | C.NaOH | D.NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/ mL | 0 | 5.0 | 10.0 |
| H2O/ mL | V3 | V4 | 0 |
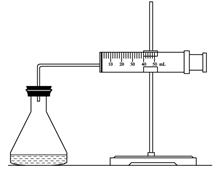
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 反应 | 纵坐标 | 甲 | 乙 |
| A | 外形、大小相近的金属和水反应 | 反应速率 | Mg] | Na |
| B | 4 mL 0.01 mol/L的KMnO4溶液,分别和不同浓度的H2C2O4(草酸)溶液各2mL反应 | 0.1 mol/L的H2C2O4溶液 | 0.2 mol/L的H2C2O4溶液 | |
| C | 5 mL 0.1 mol/L Na2S2O3溶液和5 mL 0.1 mol/L H2SO4溶液反应 | 热水 | 冷水 | |
| D | 5 mL 4%的过氧化氢溶液分解放出O2 | 无MnO2粉末 | 加MnO2粉末 |
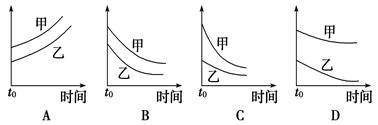
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间 |
| ① | 薄片 | 15 | 200 |
| ② | 薄片 | 25 | 90 |
| ③ | 粉末 | 25 | 10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Si(s) + 4HCl(g) △H>0,下列措施能提高反应速率且使平衡向正反应方向移动的是
Si(s) + 4HCl(g) △H>0,下列措施能提高反应速率且使平衡向正反应方向移动的是| A.升温 | B.加压 | C.减压 | D.加催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO1△H = Q1kJ·mol-1反应速度为v1,
2CO1△H = Q1kJ·mol-1反应速度为v1, 2NH3 △H = -Q2kJ·mol-1反应速度为v2,对于上述反应,
2NH3 △H = -Q2kJ·mol-1反应速度为v2,对于上述反应,| A.同时增大 | B.同时减小 | C.增大,减小 | D.减小,增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO(g)正反应速率增大的措施是
2CO(g)正反应速率增大的措施是| A.减小CO的浓度 | B.增大碳的质量 | C.通入He气 | D.增大CO2浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com