
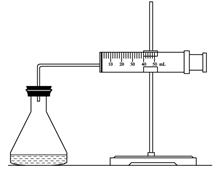
| ʵ���� �Լ� | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/ mL | 0 | 5.0 | 10.0 |
| H2O/ mL | V3 | V4 | 0 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ֻ�Тڢۢ� | B��ֻ�Тڢ� | C��ֻ�Т� | D��ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����̿���м���KClO3����ȼʱȼ�ո�Ϊ���� |
| B��H2O2�м�������MnO2������Ѹ�ٷų����� |
| C����̿�����ɷ�ĩ״����ʹȼ�ո��ӳ�� |
| D�����ˮʱ�������������ʹ������ʼӿ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ѹǿһ���ܼӿ컯ѧ��Ӧ����. |
| B��ʹ�ô���,ʹ��Ӧ�Ļ�ܽ���,��Ӧ���ʼӿ�,�����ı䷴Ӧ������. |
| C����С��Ӧ��Ũ�ȿ��Լ�С��ѧ��Ӧ���ʳ���,�Ӷ���С��ѧ��Ӧ����. |
| D�������¶�,һ���ܼӿ컯ѧ��Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
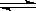 2NH3(g)��H��-92kJ��mol��1���й��ڴ˷�Ӧ��˵���д�����ǣ� ��
2NH3(g)��H��-92kJ��mol��1���й��ڴ˷�Ӧ��˵���д�����ǣ� �� | A����ѹ��ʹ�÷�Ӧ�ķ�Ӧ���ʱ�� |
| B�������¶ȣ��÷�Ӧ�������淴Ӧ���ʾ���� |
| C����1molN2��3molH2��Ͻ��з�Ӧ����Ӧ���ʱ�ų�������Ϊ92kJ |
| D����λʱ��������1molN2��ͬʱ����3molH2˵���÷�Ӧ�ﵽƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��100mL0.1mol/L���� | B��100mL0.2mol/L���� |
| C��75 mL0.2mol/L���� | D��20mL18.4mol/L���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ô�п��ϡ���ᷴӦ | B���ô�п��ϡ���ᷴӦ |
| C���ô�п��ϡ���ᷴӦ | D����CuSO4��Һ�н��ݹ��Ĵ�п��ϡ���ᷴӦ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���������̾���ǿ�����ԣ�������H2O2�ֽ�������� |
| B�������������ˮ������Ư���ԣ������ʹ�ý���ǿƯ��Ч�� |
| C����ʢ��ʳƷ�İ�װ���з���ʢ�й轺�����۵���С��,�ɷ�ֹʳ���ܳ����������� |
| D��п��ϡ���ᷴӦʱ���뼸������ͭ��Һ�ɼӿ췴Ӧ���ʣ�ԭ��������ͭ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

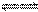 2NH3(g)����H����92.4 kJ��mol��1���ڷ�Ӧ�����У�����Ӧ���ʵı仯����ͼ�� ����˵����ȷ����(�� ��)
2NH3(g)����H����92.4 kJ��mol��1���ڷ�Ӧ�����У�����Ӧ���ʵı仯����ͼ�� ����˵����ȷ����(�� ��)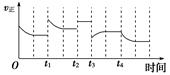
| A��t1ʱ�������¶� | B��t2ʱʹ���˴��� |
| C��t3ʱ������ѹǿ | D��t4ʱ�������¶� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com