
����Ŀ����֪��A��B��C��D��E��F�ڳ����¾�Ϊ���壬����������ת����ϵ�����ַ�Ӧ��������������ȥ����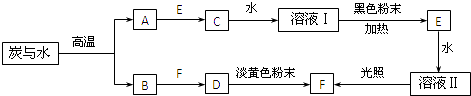
��ش��������⣺
��1����A��ȼ�����뵽װ��E�ļ���ƿ�У��ɹ۲쵽�������� ��
��2��C��Ũ��Һ���ɫ��ĩ��Ӧ����E�Ļ�ѧ����ʽΪ ��
��3��������Һ����뵽�⻯����Һ�У�������Ӧ�����ӷ���ʽΪ �� ��Ӧ�����Һ�м�������CCl4 �� ������ã����Թ۲쵽�������� ��
��4������Һ��Ƚϣ���Һ���ж�������������ѧʽ����
���𰸡�
��1��������ɫ���棬��������������
��2��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��3��Cl2+2I���TI2+2Cl����Һ���Ϊ���㣬�ϲ�Ϊ��ɫ���²�Ϊ�Ϻ�ɫ
��4��Cl2��HClO
���������⣺̿��ˮ�ڸ���������CO��H2 �� B������F��������D��D�뵭��ɫ��ĩ��Ӧ����F��Ӧ��CO2��Na2O2��Ӧ����̼����������������֪BΪCO��FΪO2 �� DΪCO2 �� ��AΪH2 �� ����E��ˮ��Ӧ�����տɵ�����������֪EΪCl2 �� ��Һ��Ϊ��ˮ�����ת����ϵ��֪��CΪHCl������ˮ����Һ��Ϊ���ᣬŨ�������ɫ��ĩ�������̷�Ӧ�ɵ�����������ת����ϵ����1����������ȼ�����˵�װ�������ļ���ƿ�У������������м���ȼ�գ�������ɫ���棬�������������������Դ��ǣ�������ɫ���棬������������������2��Ũ�������ɫ��ĩ�������̷�Ӧ�����Ȼ�þ��������ˮ����Ӧ����ʽΪ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O�����Դ��ǣ�MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O�����Դ��ǣ�MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O����3��������ˮ���뵽�⻯����Һ�У������������������ɵⵥ�ʣ�����������Ϊ�����ӣ���Ӧ���ӷ���ʽΪ��Cl2+2I���TI2+2Cl�� �� ��Ӧ�����Һ�м�������CCl4 �� ������ã���ȡ��Һ�еĵ⣬CCl4�ܶȱ�ˮ�����Իῴ��Һ���Ϊ���㣬�ϲ�Ϊ��ɫ���²�Ϊ�Ϻ�ɫ�����Դ��ǣ�Cl2+2I���TI2+2Cl����Һ���Ϊ���㣬�ϲ�Ϊ��ɫ���²�Ϊ�Ϻ�ɫ����5������ҺIΪ���Ậ�У�H2O��H+��Cl�� �� ��Һ��Ϊ��ˮ������H2O��Cl2��HClO��H+��Cl�� �� ��ҺII�ж����������Cl2��HClO�����Դ��ǣ�Cl2��HClO��
MnCl2+Cl2��+2H2O����3��������ˮ���뵽�⻯����Һ�У������������������ɵⵥ�ʣ�����������Ϊ�����ӣ���Ӧ���ӷ���ʽΪ��Cl2+2I���TI2+2Cl�� �� ��Ӧ�����Һ�м�������CCl4 �� ������ã���ȡ��Һ�еĵ⣬CCl4�ܶȱ�ˮ�����Իῴ��Һ���Ϊ���㣬�ϲ�Ϊ��ɫ���²�Ϊ�Ϻ�ɫ�����Դ��ǣ�Cl2+2I���TI2+2Cl����Һ���Ϊ���㣬�ϲ�Ϊ��ɫ���²�Ϊ�Ϻ�ɫ����5������ҺIΪ���Ậ�У�H2O��H+��Cl�� �� ��Һ��Ϊ��ˮ������H2O��Cl2��HClO��H+��Cl�� �� ��ҺII�ж����������Cl2��HClO�����Դ��ǣ�Cl2��HClO��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵĵ���ƽ�⡢�����ˮ��ƽ�����������ܽ�ƽ������ڻ�ѧƽ�⣬����Ҫ��ش�����������
��1���� ZnSO4��Һ�еμӱ���H2S��Һ��û�г������ɣ������μ�һ�����İ�ˮ������ZnS�������õ���ƽ��ԭ�������������� _______________________________________________ ��
��2��AlCl3��Һ���ɲ����յõ���������__________ ���ѧʽ����
��3��0.1 mol��L��1��(NH4)2SO4��Һ���ڸ���Һ�и������ӵ�Ũ���ɴ�С˳��Ϊ_____________��
��4��0.1mol��L��1��NaHA��Һ�У�����Ũ���ɴ�С��˳��Ϊ��c��Na+��>c��HA����>c��H2A��>c��A2����
�ٸ���Һ����________������������������������������������
�����������жϵ�������___________________________________________�������ֽ��ͣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��I��������һ�������¿�������������
A��̼�����ӣ�CH3+ �� B��̼�����ӣ�CH3���� C���� ����CH3�� D��̼ϩ����CH2��
���������У�����Ϊ120�����������ţ���
��̼�����ӣ�CH3�����Ŀռ乹��Ϊ �� ��CH3����Ϊ�ȵ������һ�ַ��������ѧʽ����
��II ������ȡ�ϳɰ�ԭ�����Ĺ����У�������һЩ���ʣ���CO��ʹ�����ж�����ȥCO�Ļ�ѧ����ʽΪ��HAc��ʾ���ᣩ��Cu��NH3��2Ac+CO+NH3=Cu��NH3��3��CO��Ac����ش��������⣺
��C��N��O�ĵ縺���ɴ�С��˳��Ϊ ��
��д��Cu�ĺ�������Ų�ʽ ��
�ۻ�����Cu��NH3��3��CO��Ac�У�����Ԫ�صĻ��ϼ�Ϊ ��
����һ��������NH3��CO2�ܺϳ�����CO��NH2��2 �� ������Cԭ�ӹ�����ӻ�����Ϊ��1mol���ط����У��� ������ĿΪ ��
��Cu2O����ľ����ṹ��ͼ��ʾ��������٤������ΪNA �� �����ı߳�Ϊapm��������ܶ�Ϊgcm��3 �� 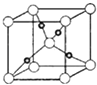
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ȳ����������ȷ����(����)
A.�����ﺬ��̼̼�����IJ�����������Ȳ��
B.Ȳ�������������̼ԭ�Ӷ���ͬһֱ����
C.Ȳ�������ӳɷ�Ӧ��Ҳ����ȡ����Ӧ
D.Ȳ������ʹ��ˮ��ɫ��������ʹ���Ը��������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ú��ʯ�͡���Ȼ������Դ��˵����ȷ����(����)
A.ʯ���ѽ�õ��������Ǵ�����
B.ʯ�Ͳ�Ʒ�������ھۺϷ�Ӧ
C.��Ȼ����һ�����Ļ���ԭ��
D.ˮú����ͨ��ú��Һ���õ�������ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z��Ϊԭ��������������Ķ���������Ԫ�أ�W��X��Y����ͬһ���ڣ�WԪ���γɵĻ�����������࣬W��Y������֮��ΪX��������2����Z������������Ӧ��ˮ��������������������ڼ����˵������ȷ���ǣ� ��
A.����̬�⻯��е�Y��X��W
B.ԭ�Ӱ뾶Z��Y��X��W
C.YԪ�ؿ���λ�ڵڶ����ڵڢ�A��
D.YԪ������������Ԫ�ؾ����γɶ��ֻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������п�̸ɵ�����й�������ȣ���������뻷�����������Σ����ij��ѧ��ȤС����������´����������շϵ���еĸ�����Դ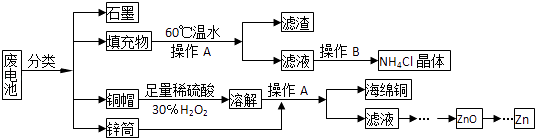
��1���������60����ˮ�ܽ⣬Ŀ���� ��
��2������A������Ϊ ��
��3��ͭñ�ܽ�ʱ����H2O2��Ŀ�������û�ѧ����ʽ��ʾ����ͭñ�ܽ���ȫ�ɲ���������ȥ��Һ�й�����H2O2 ��
��4������п�̸ɵ�صĵ����ΪKOH���ܷ�ӦΪZn+2MnO2+2H2O�T2MnOOH+Zn��OH��2 �� �为���ĵ缫��ӦʽΪ ��
��5����������Ҫ�ɷ�Ϊ���̻������̻�����м���һ������ϡ���ᡢϡ���ᣬ�����Ͻ�����������Ϊֹ����Ҫ��ӦΪ2MnO��OH��+MnO2+2H2C2O4+3H2SO4�T3MnSO4+4CO2��+6H2O���ٵ�1molMnO2�μӷ�Ӧʱ��������Ӧ����mol���ӷ���ת�ƣ�
��MnO��OH����Ũ�����ڼ���������Ҳ�ɷ�����Ӧ����д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȲΪԭ����ȡCH2Br��CHBrCl�����еķ�Ӧ;����(����)
A.�ȼ�Cl2 �� �ټ�Br2
B.�ȼ�Cl2 �� �ټ�HBr
C.�ȼ�HCl���ټ�HBr
D.�ȼ�HCl���ټ�Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨH3BO3������Ӧ���ڲ���������ҵ������þ��2MgOB2O3H2O��SiO2������Fe3O4��CaCO3��Al2O3��Ϊԭ����������Ĺ���������ͼ�� 
��֪��i��Fe3+��Al3+��Fe2+��Mg2+������������ʽ��ȫ����ʱ����Һ��pH�ֱ�Ϊ3.2��5.2��9.7��12.4��
����H3BO3��20�桢40�桢60�桢100��ʱ���ܽ������Ϊ5.0g��8.7g��14.8g��40.2g��
��1��Ϊ�������þ��۵Ľ����ʣ��ɲ�ȡ�Ĵ�ʩ�������ٴ���������
��2��������Һ�������ԣ���H3BO3��Mg2+��SO42�� �� ������Fe3+��Fe2+��Ca2+��Al3+�����ʣ������ӡ�ʱ�����Һ�����μ�������H2O2��MgO��H2O2���������������ӷ���ʽ��ʾ����MgO��ȥ������������ ��
��3����֪H3BO3�������NaOH��Ӧ����Na[B��OH��4]����д��H3BO3����Һ�еĵ��뷽��ʽ ��
��4������ȡ�����á��ȹ��ˡ���Ŀ���� �� ĸҺ�е���Ҫ������ ��
��5���ⶨ���ò�Ʒ�Ĵ��ȣ�ȡa g���ᣬС�ļ���ʹ��ֽ���ȥˮ�֣��������Ȳ��ֽ⣩���ò�������b g�����Ʒ�Ĵ���Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com