
 【化学--物质结构与性质】
【化学--物质结构与性质】- 2 |
- 3 |
- 2 |
| 1 |
| 8 |
| 1 |
| 4 |
| 24 |
| 24+39+19×3 |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 737 | 1451 | 7733 | 10540 |

查看答案和解析>>
科目:高中化学 来源: 题型:
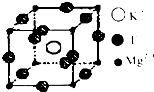
 (2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是查看答案和解析>>
科目:高中化学 来源: 题型:
 碳原子的杂化轨道类型为
碳原子的杂化轨道类型为查看答案和解析>>
科目:高中化学 来源: 题型:
 (2010?济南二模)【化学-物质结构与性质】
(2010?济南二模)【化学-物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
 【化学-物质结构与性质】
【化学-物质结构与性质】查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com