
| A. | 从海水中提取溴必须通过化学反应才能实现 | |
| B. | 用侯氏制碱法制纯碱必须通过化学反应才能实现 | |
| C. | 用“地沟油”纯化生产“生物燃油”的过程发生的是化学变化 | |
| D. | 石墨在高温高压下转变为金刚石是化学变化 |
分析 A.海水中存在溴离子;
B.氯化钠、二氧化碳、氨气反应生成碳酸氢钠和氯化铵;
C.“地沟油”纯化没有新物质生成;
D.石墨在高温高压下转变为金刚石有新物质生成.
解答 解:A.海水中存在溴离子得到溴单质,有新物质生成,是化学变化,故A正确;
B.氯化钠、二氧化碳、氨气反应生成碳酸氢钠和氯化铵,碳酸氢钠受热分离生成碳酸钠,有新物质生成,是化学变化,故B正确;
C.“地沟油”纯化没有新物质生成,属于物理变化,故C错误;
D.墨在高温高压下转变为金刚石有新物质生成,属于化学变化,故D正确.
故选C.
点评 本题考查物理变化与化学变化的区别与联系,难度不大,解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.


科目:高中化学 来源: 题型:解答题
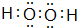 ,其所含化学键为(选代码)bc.
,其所含化学键为(选代码)bc.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| B. | 粗铜精炼时,当阳极质量减少6.4 g时,电路中转移的电子数一定不是0.2NA | |
| C. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA | |
| D. | 200 mL 0.5 mol•L-1 Na2CO3溶液中,由于CO32-水解,所以阴离子的数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
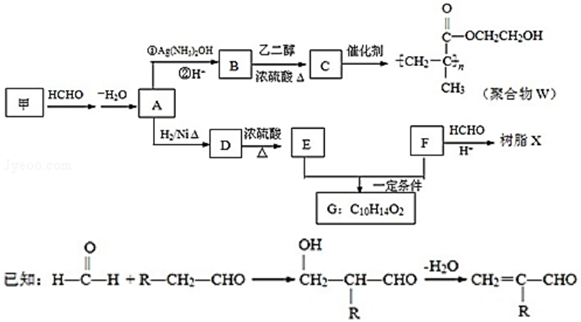
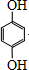
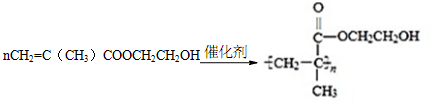 .
.
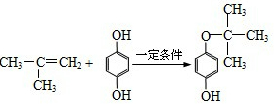 ,反应类型是加成反应.
,反应类型是加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①③④⑤ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 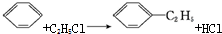 | B. | 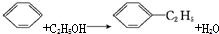 | ||
| C. | 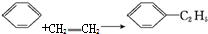 | D. | 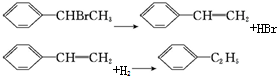 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸溶液 CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水跟盐酸反应 H++OH-═H2O | |
| C. | 碳酸钡溶于醋酸 BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属钠跟水反应 Na+H2O═Na ++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com