
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ②①③ |
分析 溶液含有Ba2+、Cu2+、Ag+,应先加入HCl,生成AgCl沉淀,过滤后在加入K2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,以此解答该题.
解答 解:Ag+、Cu2+均与NaOH反应生成沉淀,Ba2+、Ag+均与K2SO4溶液反应生成沉淀,则这三种离子逐一沉淀并加以分离,应先加入HCl,生成AgCl沉淀,过滤后在加入K2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,即顺序为③②①,
故选B.
点评 本题考查常见离子的检验及分离,为高频考点,把握离子之间反应为解答的关键,侧重分析与应用能力的考查,注意逐一沉淀的条件限制,题目难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:实验题
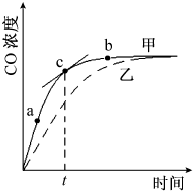 氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75:2);②在碳存在下,X与N2反应生成AlN.请回答:
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75:2);②在碳存在下,X与N2反应生成AlN.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
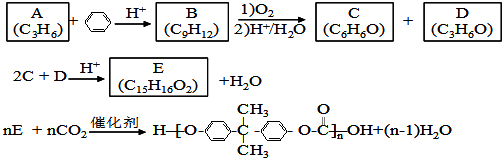
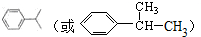 ;
;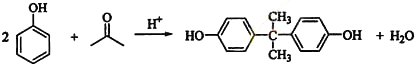 ;
;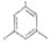 (写出结构简式).
(写出结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O 与 CO2均不含非极性键 | |
| B. | N2O 的电子式可 | |
| C. | N2O 为三角形分子 | |
| D. | N2O 与 SiO2互为等电子体,具有相似的结构和相似性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )
如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )| A. | t1℃时,N比M的溶解度大 | |
| B. | 温度从t1℃升高到t3℃时,N的饱和溶液张溶质的质量分数将增大 | |
| C. | M比N的溶解度大 | |
| D. | N中含有少量M时,可用降温结晶法提纯N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
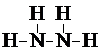 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=3的溶液中:Na+、NO3-、Cl-、Al3+ | |
| B. | 使pH试纸呈红色的溶液中:Fe2+、ClO-、SO42-、Na+ | |
| C. | 由水电离出的c(H+)=10-13 mol•L-1的溶液中:CO32-、SO42-、Cl-、Na+ | |
| D. | 加入铝粉后产生大量氢气的溶液中:NH4+、Na+、SO42-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com