
 如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )
如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )| A. | t1℃时,N比M的溶解度大 | |
| B. | 温度从t1℃升高到t3℃时,N的饱和溶液张溶质的质量分数将增大 | |
| C. | M比N的溶解度大 | |
| D. | N中含有少量M时,可用降温结晶法提纯N |
分析 A.由图可知,t1℃时,N的溶解度大;
B.温度从t1℃升高到t3℃时,N的饱和溶液会析出固体N;
C.没有说明温度,无法比较;
D.降低温度N的溶解度会增大.
解答 解:A.由图可知,t1℃时,N对应的曲线在M的曲线的上方,所以N比M的溶解度大,故A正确;
B.温度从t1℃升高到t3℃时,N的溶解度减小,N的饱和溶液会析出固体N,所以N的饱和溶液的质量分数减小,故B错误;
C.没有说明温度,无法比较,t1℃时N的溶解度大,而t3℃时M的溶解度大,故C错误;
D.降低温度N的溶解度会增大,所以降低温度N不能析出固体,所以N中含有少量M时,不能用降温结晶法提纯N,故D错误.
故选A.
点评 本题考查了溶度积随温度的变化曲线,题目难度不大,注意把握图中曲线的含义以及影响溶解度大小的因素,侧重于考查学生的分析能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠是淡黄色固体,久置于空气中变成白色的氢氧化钠固体 | |
| B. | 过氧化钠中阴阳离子比例为1:2 | |
| C. | 用过氧化钠漂白织物、麦秆等日久又逐渐变成黄色 | |
| D. | Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

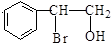 ,F分子中含有的含氧官能团名称是羟基、羧基(顺序可以颠倒).
,F分子中含有的含氧官能团名称是羟基、羧基(顺序可以颠倒). .
.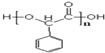 .
.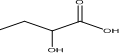 的合成线路:H2C=CHCH2CH3$\stackrel{HBrO}{→}$HOCH2CHBrCH2CH3→CH3CH2CHBrCOOH$\stackrel{NaOH(aq)△}{→}$CH3CH2CHOHCOOH.
的合成线路:H2C=CHCH2CH3$\stackrel{HBrO}{→}$HOCH2CHBrCH2CH3→CH3CH2CHBrCOOH$\stackrel{NaOH(aq)△}{→}$CH3CH2CHOHCOOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
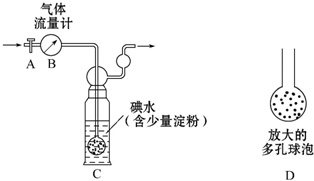 硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放.某化学研究性学习小组的同学欲采用以下方案测定硫酸工业尾气中SO2含量
硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放.某化学研究性学习小组的同学欲采用以下方案测定硫酸工业尾气中SO2含量查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验序号 | 操作 | 现象 |
| 实验一 | 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中: (I)加热初期,Cu片表面变黑,溶液近乎无色 (II)继续加热,铜片表面产生气泡,形成黑色浊液,三口瓶底部有灰黑色固体沉积 (III)继续加热,有大量白雾生成,浊液变澄清,三口瓶底部有大量白色固体(因含有极少量黑色固体而显灰白色),Cu片消失B中有气泡冒出,溶液褪色 |
| 实验二 | 停止加热,冷却,将三口瓶中的上清液倒入盛有水的烧杯中 | 三口瓶中留有大量白色固体(因含有极少量黑色固体而显灰白色) 烧杯中溶液温度升高,溶液只略带蓝色 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
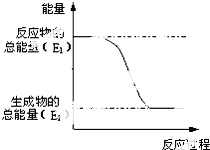 (1)“西气东输”中的“气”指天然气,其主要成分的化学式是CH4,
(1)“西气东输”中的“气”指天然气,其主要成分的化学式是CH4,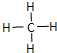 .一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.
.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 事 实 | 结 论 | |
| A | A、B两种有机物具有相同的相对分子质量和不同的结构 | A、B互为同分异构体 |
| B | 质量相同的A、B两种有机物完全燃烧生成质量相同的水 | A、B两有机物最简式相同 |
| C | A、B两种有机物结构相似具有相同的通式 | A、B互为同系物 |
| D | 分子式为C6H6的烃A既能使溴的CCl4溶液褪色,又能使酸性KMnO4溶液褪色 | A的结构简式可能是 CH2═CH-C≡C-CH═CH2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com