
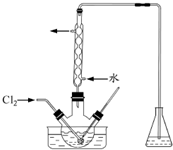
 实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:分析 碘废液加亚硫酸钠溶液,把单质碘还原为I-,四氯化碳难溶于水,会分层,则分液即可得到四氯化碳,剩余的溶液中加氯气氧化I-得到I2,富集,最后得到较纯的I2,(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘;碘微溶于水,而碘离子易溶于水;
(2)碘易升华,且氯气的溶解度随着温度的升高而减小;氯气、碘蒸气都能和氢氧化钠溶液反应生成无毒物质;
(3)碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色.
解答 解:碘废液加亚硫酸钠溶液,把单质碘还原为I-,四氯化碳难溶于水,会分层,则分液即可得到四氯化碳,剩余的溶液中加氯气氧化I-得到I2,富集,最后得到较纯的I2,
(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘离子,离子反应方程式为SO32-+I2+H2O=2I-+2H++SO42-;碘微溶于水,而碘离子易溶于水,为了使更多的I元素进入水溶液应将碘还原为碘离子;
故答案为:SO32-+I2+H2O=2I-+2H++SO42-;使CCl4中的碘进入水层;
(2)碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在低温条件下进行反应;氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气和碘蒸气,
故答案为:防止碘升华,增大氯气的溶解度;氢氧化钠;
(3)碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色,所以其检验方法为:从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,5SO32-+2 IO3-+2H+=I2+5SO42-+H2O,若溶液变蓝色,说明废水中含有IO3-,否则不含IO3-,
故答案为:从水层取少量溶液,加入1-2ml淀粉溶液,加盐酸酸化,滴加亚硫酸钠,若溶液变蓝,说明废水中含有碘酸根离子,若溶液不变蓝,说明不含碘酸根.
点评 本题以物质的制备为载体考查了氧化还原反应、离子的检验、物质的分离和提纯,明确物质的性质是解本题关键,根据物质的特殊性质、混合物分离和提纯方法的选取等方面来分析解答,知道碘的检验方法,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
| 信息 | 问题 |
| ①短周期元素X、Y、Z、W,原子序数依次增大,最外层电子数均不少于最内层电子数 | (1)X一定不是AD A.氢 B.碳 C.氧 D.硫 |
| ②一定条件下,上述四种元素的单质均能与足量的氧气反应,生成的氧化物有两种能溶于稀硫酸,三种能溶于浓NaOH溶液,氧化物的相对分子质量都大于26 | (2)这四种元素中有铝元素吗?可能 |
| ③向上述四种元素的单质的混合物中,加入足量的盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中有白色沉淀 | (3)白色沉淀的化学式为Mg(OH)2 |
| ④向上述四种元素的单质的混合物中,加入足量的烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸,最终溶液中有白色沉淀 | (4)生成白色沉淀的离子方程式为SiO32-+2H+=H2SiO3↓(或SiO32-+2H++H2O=H4SiO4↓) |
| ⑤X与W同主族 | (5)X的最高价氧化物的电子式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>D>B | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
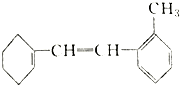 有机物M的结构简式如图所示.
有机物M的结构简式如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com