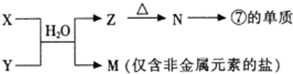
A、B、C、D、E、F、G都是短周期主族元素,它们的核电荷数依次增大.元素A的原子核内仅有一个质子,A、D同主族,B、C为同周期元素且与A能形成相同电子数的化合物,C与F同主族,F的质子数为C的2倍,元素E的最外层电子数比K层电子数多1,B、C、F的质子数之和等于E、G的质子数之和.请回答下列问题:
(1)写出由上述至少两种元素组成的具有漂白作用的物质的化学式
SO2、Na2O2、HClO、NaClO
SO2、Na2O2、HClO、NaClO
(至少写出四种).
(2)A分别与B、C、G能形成相应的最常见三种化合物,这三种化合物的沸点由高到低的顺序为
H2O>HCl>CH4
H2O>HCl>CH4
(用化学式表示).
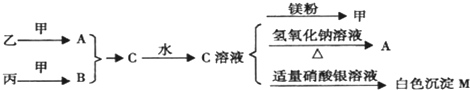
(3)由A、B、C、D四种元素组成的一种常见化合物的溶液分别与由A、C、D、E四种元素组成的一种化合物的溶液和由E、G两种元素组成的一种化合物的溶液都能反应得到同一种白色沉淀,写出上述两个反应的离子方程式
HCO3-+[Al(OH)4]-+H2O═CO32-+Al(OH)3↓
HCO3-+[Al(OH)4]-+H2O═CO32-+Al(OH)3↓
、
3HCO3-+Al3+═Al(OH)3↓+3CO2↑
3HCO3-+Al3+═Al(OH)3↓+3CO2↑
.
(4)D、E两种元素的原子都能形成相应的离子,则两离子半径大小关系为
r(Na+)>r(Al3+)
r(Na+)>r(Al3+)
(用离子符号表示);将D、E两种元素的单质同时投入水中,充分反应后,测得溶液中只有一种溶质,且无固体物质剩余,则所投入到水中的D的单质和E的单质的质量之比为
23:27
23:27
,上述反应的化学方程式为
Na+Al+4H2O═Na[Al(OH)4]+2H2↑
Na+Al+4H2O═Na[Al(OH)4]+2H2↑
;若D的单质的物质的量为x mol,则上述反应中得到另一物质的物质的量为
2xmol
2xmol
.

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案