
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO4 2- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
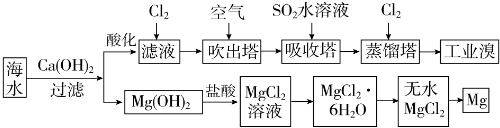
分析 海水中加入氢氧化钙沉淀镁离子后过滤,在滤液中通入CL2是将滤液中的Br-氧化为Br2,再利用热的空气将Br2吹出,进入吸收塔与SO2反应,其反应的离子方程式为:SO2+Br2+2H2O=4H++2Br-+SO42-;再通入CL2将Br-氧化为Br2,两次Br-→Br2转化的目的是对溴元素进行富集,氢氧化镁加入盐酸溶解得到氯化镁溶液,氯化镁溶液中得到氯化镁晶体的 操作是加热蒸发冷却结晶得到无水氯化镁,电解熔融氯化镁得到金属镁;
(1)①提取溴的过程中,经过2次Br-→Br2转化的目的是更多的得到溴单质;
②吸收塔内通入的是二氧化硫气体是和溴单质反应生成溴离子,在蒸馏塔中被氯气氧化得到更多的溴单质;通空气的目的是溴单质被空气带出;
③Br2(g)?Br2(aq)(或Br2+H2O?HBr+HBrO)平衡逆向进行分析;
(2)根据3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3反应中,溴元素的化合价由0价分别变为-1价和+5价,其它各元素的化合价都不变,溴既是氧化剂又是还原剂,结合元素化合价变化解答该题;
(3)①溶液中得到溶质固体的方法是蒸发浓缩、冷却结晶、过滤洗涤得到;
②最后一步冶炼得到金属镁是电解熔融氯化镁得到金属镁和氯气;
③若有少量水存在会造成产品镁的消耗是因为镁和水反应生成氢氧化镁沉淀和氢气;
氢氧化镁和盐酸反应生成氯化镁溶液;
(4)依据离子方程式计算得到需要的氯气体积.
解答 解:(1)①依据利用海水可以提取溴和镁,流程中提取溴的过程中,经过2次Br-→Br2转化的目的是更多的得到溴单质,提取过程对溴元素进行富集,
故答案为:对溴元素进行富集;
②吸收塔内通入的是二氧化硫气体是和溴单质反应生成溴离子,在蒸馏塔中被氯气氧化得到更多的溴单质,吸收塔中反应的离子方程式为;SO2+Br2+2H2O=4H++2Br-+SO42-;
故答案为:对溴元素进行富集;SO2+Br2+2H2O=4H++2Br-+SO42-;
③通入空气将溴蒸气带出,Br2(g)?Br2(aq)(或Br2+H2O?HBr+HBrO)平衡逆向进行,溴蒸气挥出,
故答案为:通入空气将溴蒸气带出,使Br2(g)?Br2(aq)(或Br2+H2O?HBr+HBrO)平衡向左移动;
(2)反应3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3中,溴元素的化合价由0价分别变为-1价和+5价,溴既是氧化剂又是还原剂,氧化产物是溴酸钠,还原产物是溴化钠,由化学方程式可知氧化剂和还原剂物质的量之比为5:1,用双线桥标出电子转移的方向和数目为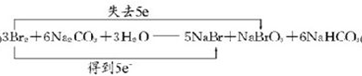 ,
,
故答案为: ;
;
(3)①从MgCl2溶液中得到MgCl2•6H2O晶体的主要操作是蒸发浓缩、冷却结晶、过滤洗涤得到,故答案为:加热浓缩、冷却结晶;
②从MgCl2溶液中得到MgCl2固体,电解熔融氯化镁得到金属镁和氯气,反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
③若有少量水存在会造成产品镁的消耗是因为镁和水反应生成氢氧化镁沉淀和氢气,反应的化学方程式为:Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑,
故答案为:Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑;
(4)若将10m3海水中的溴元素转化为工业溴,依据图表中溴元素含量为64mg/L,10m3海水中含溴元素=10×1000L×64g/L×10-3=640g;物质的量=$\frac{640g}{80g/mol}$=8mol,依据反应计算得到:2Br-+Cl2=Br2+2Cl-,消耗氯气物质的量为:4mol;提取过程中需要两次通入氯气实现溴离子被氧化,所以至少需要标准状况下Cl2的物质的量为8 mol标准状况下体积为 8mol×22.4L/mol=179.2L,
故答案为:179.2.
点评 本题考查了海水淡化的电渗析原理的分析判断,海水中溴的提取过程,溶液中得到固体的条件应用,反应过程中的氧化剂计算,注意氯气两次氧化消耗,题目难度中等.


科目:高中化学 来源: 题型:推断题
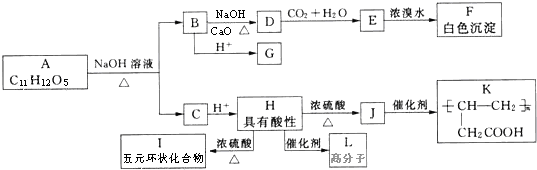
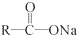 +NaOH $→_{△}^{CaO}$R-H+Na2CO3
+NaOH $→_{△}^{CaO}$R-H+Na2CO3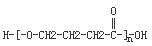 +(n-1)H2O.
+(n-1)H2O.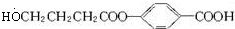 ;A生成B和C的反应方程式:
;A生成B和C的反应方程式: .
.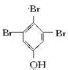 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和H2O | B. | CCl4和KCl | C. | NaCl和HCl | D. | SO2和SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 0.012kg碳-12含有约6.02×1023个碳原子 | |
| C. | 阿伏伽德罗常数的数值约等于6.02×1023 | |
| D. | 使用摩尔时必须指明微粒的名称 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷 | B. | 乙烷和丙烷 | C. | 乙烷和甲烷 | D. | 戊烷和己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(W)=v(Z) | B. | 2v(X)=3v(Z) | C. | v(X)=2v(Y) | D. | 3v(W)=2v(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液导电的过程实际上就是电解的过程 | |
| B. | 利用电解饱和食盐水所得的产物可以生产盐酸 | |
| C. | 铜在酸性环境中易发生析氢腐蚀 | |
| D. | 利用下面反应H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0,不可以设计成原电池装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从物质的分类角度来看,油条配方中的“明矾、碱”均属于盐 | |
| B. | 放置过程发生的反应为氧化还原反应 | |
| C. | 放置过程发生的反应中反应物和生成物均为电解质 | |
| D. | 反应的离子方程式为:3CO32-+2KAl(SO4)2•12H2O═3Na2SO4+2K++4SO42-+3CO2↑+2Al(OH)3↓+21 H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com