
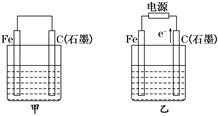
 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH- Cl2↑+H2↑+2OH-.③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3.(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应为:Fe-2e- === Fe2+.②乙装置为电解池,电解反应为:2CuSO4+2H2O
Cl2↑+H2↑+2OH-.③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3.(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应为:Fe-2e- === Fe2+.②乙装置为电解池,电解反应为:2CuSO4+2H2O  2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态.由电解反应式可知,2H+~CuO~CuCO3,电解后n(H+)=0.1×0.2=0.02(mol),
2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态.由电解反应式可知,2H+~CuO~CuCO3,电解后n(H+)=0.1×0.2=0.02(mol), ×80=0.8(g),m(CuCO3)=0.02×
×80=0.8(g),m(CuCO3)=0.02× ×124=1.24(g).
×124=1.24(g).

科目:高中化学 来源:不详 题型:单选题
| A.Ba(OH)2·8H2O与NH4Cl反应 | B.氢氧化钠与稀盐酸反应 |
| C.灼热的炭与CO2反应 | D.H2与O2的反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④ | B.②③ | C.② | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
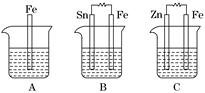
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2H++2e—→H2↑ | B.Fe2++2e—→Fe |
| C.2H2O+O2+4e—→4OH— | D.Fe3++e—→Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
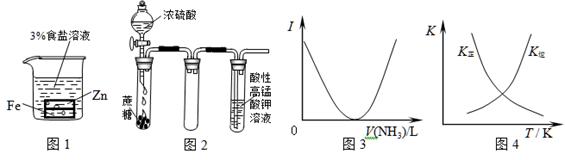
| A.图1:负极反应是Fe-2e-=Fe2+ |
| B.图2:酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
| C.图3:可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I )的变化 |
D.图4:可表示在恒容密闭容器中反应“2SO2(g) +O2(g) 2SO3(g) ΔH<0”的平衡常数K正、K 2SO3(g) ΔH<0”的平衡常数K正、K |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
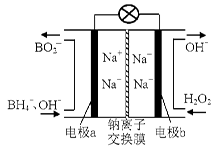
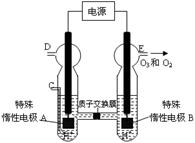
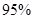 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g) 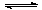 NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是 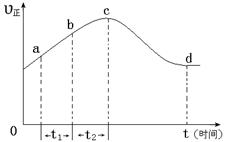
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工作时,电解质溶液的PH逐渐增大 |
| B.工作时,能见到浅蓝色火焰 |
| C.工作时,H2为正极,O2为负极 |
| D.电极反应式为:负极:2H2+4OH――4e-=4H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 正极材料 | Cu | 石墨 | Fe | Ag |
| 负极材料 | Fe | Cu | Cu | Cu |
| 电解质液 | CuSO4 | Fe2(SO4)3 | FeCl3 | AgNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com