
【题目】配置480mL 0.1molL-1CuSO4溶液为例,所需容量瓶的规格__________,需称量胆矾的
质量是__________g,配置成功后从容量瓶中取出10mL于试管中,则试管中溶液的浓度是__________molL-1
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】以乙烯为原料合成化合物C的流程如图所示:

(1)写出A的结构简式:__________________。
(2)C中含有的官能团名称为_________________。
(3)①③的反应类型分别为 和 。
(4)写出乙酸的属于酯的同分异构体的结构简式:_____________________。
(5)写出反应②和④的化学方程式:
②________________________________________________________________;
④________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,如果取0.1molL-1HA溶液与0.1molL-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1molL-1NaOH溶液中由水电离出的OH-浓度之比为_________;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH _____7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排 列顺序为_________(填序号)。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl.
(2)清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。
一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)CH3OH(g)△H=-105kJmol-1.向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是_________;
②反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=_________;
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=_________;
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”),判断的理由是_________;
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e=2O2-)

①c电极为_________正极,d电极上的电极反应式为_________;
②图乙是用惰性电极电解100mL 0.5molL-1 CuSO4溶液,a电极上的电极反应式为_________;若a电极产生56mL(标准状况)气体,则所得溶液的pH=_________(不考虑溶液体积变化),若要使电解质溶液 恢复到电解前的状态,可加入_________(选填字母序号)
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题为《化学反应原理(选修4)》选做题。
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_____性,原因是___________;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于___________;
(3)已知在H2S溶液中存在下列平衡:H2S![]() HS-+H+
HS-+H+
①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向______移动,(填“左”或“右”)c(H+)_________。(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向______移动,(填“左”或“右”)c(S2-)_________。(填“增大”、“减小”或“不变”)
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);

(5)难溶电解质在水溶液中存在溶解平衡。某MgSO4溶液里c(Mg2+)=0.002molL-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;(该温度下Mg(OH)2的Ksp=2×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)1000ml某待测溶液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):

(1)写出生成白色沉淀B的离子方程式: 。
(2)待测液中肯定不存在的阳离子是 。
(3)若无色气体D是单一气体:判断原溶液中K+是否存在 (填是或否),若存在,求其物质的量浓度的最小值,若不存在,请说明理由: 。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是 。
②沉淀A中能与稀硝酸反应的成分是 (写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
(3)若该物质能和钠反应产生氢气,试写出该物质的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(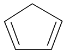 )是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线:
)是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线:
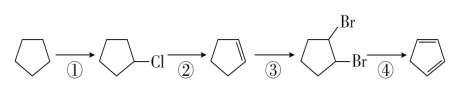
(1)其中,反应①的反应类型是______ ______,反应①的产物名称是____ ____;
反应②的反应类型是____ ____,反应②的产物名称是___ _____。
工业上可由环戊二烯制备金刚烷( ),途径如下:
),途径如下:

请回答下列问题:
(2)环戊二烯分子中最多有________个原子共平面;
(3)金刚烷的分子式为________,其分子中的二氯代物有________种;
(4)A是二聚环戊二烯的同分异构体,属于芳香烃,其苯环上的一氯代物只有二种,能使溴的四氯化碳溶液褪色。符合以上信息的A的所有可能结构(不考虑立体异构)有 种,试写出苯环上支链最多的几种同分异构体的结构简式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂可以区别MgCl2、FeCl2、AlCl3三种溶液,这种试剂是( )
A.AgNO3溶液 B.NAOH溶液 C.硫酸 D.KNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com