
【题目】按要求完成下列各题的填空:
(1)葡萄糖分子式_____。葡萄糖的检验方法有:A、在碱性、加热的条件下,与银氨溶液反应析出银。该反应被称为葡萄糖的银镜反应。B、在碱性、加热的的条件下,与新制氢氧化铜反应产生现象为___。
(2)能使蛋白质发生变性有重金属盐、甲醛(福尔马林溶液)、强酸强碱、紫外线、加热等,误食重金属离子后应喝大量___解毒。
(3)青霉素是重要的抗生素即消炎药,在使用之前要进行_________________,以防 止过敏反应的发生。维生素C又称抗坏血酸,是一种水溶性维生素,具有酸性和还原性,广泛存在于 ___________。
(4)碘是人体必需的微量元素,有“智力元素”之称。缺碘会造成________,补碘过量会造成甲状腺功能亢进。在食物中,海带、海鱼等海产品中含碘最多。加碘盐中添加的是 _____(填化学式)。
(5)铁是人体中必需微量元素中含量最多的一种。缺铁会发生____含铁较多的食物有动物内脏、动物全血、肉类、鱼类、蛋类等。
(6)羊毛、蚕丝属于蛋白质。检验蛋白质的简单方法:_________。
(7)某蛋白质分子中含铁0.28%,测知该分子的相对分子质量为20000。则该分子中含铁原子___个。(已知铁的相对原子质量为56)。
(8)将标准状况下5.6L HCl气体通入50ml水中充分吸收,然后加水冲稀至500ml,此时盐酸的物质的量浓度为____。
【答案】C6H12O6 出现砖红色沉淀 牛奶或豆浆 皮肤敏感试验(皮试) 新鲜水果和绿色蔬菜中 甲状腺肿大 KIO3 缺铁性贫血 灼烧有烧焦羽毛气味 1 0.5mol.L-1
【解析】
(1)葡萄糖是单糖,分子式为C6H12O6,其分子结构中含有醛基,能在碱性、加热的条件下,与银氨溶液反应析出银,发生银镜反应;也能在碱性、加热的的条件下,与新制氢氧化铜反应,产生砖红色沉淀;
(2)重金属离子能使蛋白质变性而中毒,误食重金属离子后应喝大量牛奶(或豆浆)来缓解毒性;
(3)青霉素是重要的抗生素即消炎药,但在使用之前要进行皮试,以防止过敏反应的发生;新鲜水果和绿色蔬菜中存在维生素C;
(4)碘是人体必需的微量元素,有“智力元素”之称,缺碘会造成甲状腺肿大;KIO3是加碘盐中最常见的添加剂;
(5)铁是人体必需的微量元素,它是血红蛋白的成分,能帮助氧气的运输,缺少铁元素,易患缺铁性贫血;
(6)检验某样品中是否含有蛋白质最简单的方法是灼烧,如果有烧焦羽毛的气味,就证明是蛋白质;
(7)一个血红蛋白分子中铁原子的相对原子质量之和为20000×0.28%=56,则铁原子的相对原子质量为56,平均每个血红蛋白分子中铁原子的个数是![]() =1;
=1;
(8)标准状况下5.6L HCl的物质的量为![]() =0.25mol,所得盐酸的物质的量浓度为
=0.25mol,所得盐酸的物质的量浓度为![]() =0.5mol.L-1。
=0.5mol.L-1。


科目:高中化学 来源: 题型:
【题目】如图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连成闭合回路,该装置在工作时,下列叙述中正确的是
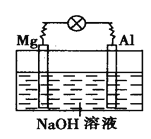
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
B. 铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
C. 该装置的内、外电路中,均是电子的定向移动形成
D. 该装置开始工作时,铝片表面的氧化膜可不必处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组化合物中,化学键类型和化合物类型均相同的是_________(填序号)。
A.CaCl2和 Na2S B.Na2O 和 Na2O2
C.CO2和CaO D.HC1 和 NaOH
(2)已知1 mol石墨转化为1 mol金刚石要吸收能量,则1 mol石墨的能量比1 mol金刚石的能量____(填“高”或“低”),石墨比金刚石_______(填“稳定”或“不稳定”)。
(3)Ba(OH)2 8H2O和NH4Cl反应的化学方程式是____________,该反应是___(填“吸热”或“放热”)反应,反应过程能量变化的图像符合_____________(填“图1”或“图2”)。
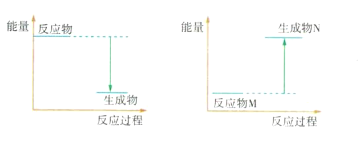
图1 图2
(4)如图3所示,把试管放入盛有饱和澄清石灰水(温度为25℃)的烧杯中,先在试管中放入几小块镁片,再用滴管滴入5mL盐酸。可以观察到烧杯中的石灰水逐渐由澄清变浑浊,出现这种现象的原因是___________________________。
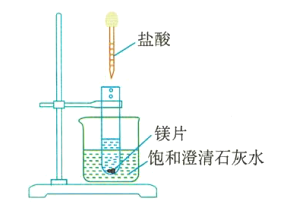
图3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于2SO2(g)+O2(g)![]() 2SO3(g) △H<0的反应,下列装置示意图中的实验不能达到目的是( )
2SO3(g) △H<0的反应,下列装置示意图中的实验不能达到目的是( )
A. 研究压强对反应的影响(p2>p1)
研究压强对反应的影响(p2>p1)
B. 研究温度对反应的影响
研究温度对反应的影响
C. 研究平衡体系中增加O2浓度对反应的影响
研究平衡体系中增加O2浓度对反应的影响
D. 体积恒定的密闭容器中催化剂对反应的影响
体积恒定的密闭容器中催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
① | |||||||||||||||||
② | ③ | ||||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | ⑩ |
请回答下列问题:
(1)表中⑨号属于______区元素。
(2)③和⑧形成的一种常见溶剂,其分子立体空间构型为________。
(3)元素①和⑥形成的最简单分子X属于________分子(填“极性”或“非极性”)
(4)元素⑥的第一电离能________元素⑦的第一电离能;元素②的电负性________元素④的电负性(选填“>”、“=”或“<”)。
(5)元素⑨的基态原子核外价电子排布式是________。
(6)元素⑧和④形成的化合物的电子式为________。
(7)某些不同族元素的性质也有一定的相似性,如表中元素⑩与元素⑤的氢氧化物有相似的性质。请写出元素⑩的氢氧化物与NaOH溶液反应的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )

A.该反应的化学方程式为3B+4D6A+2C
B.反应进行到1s时,v(A)=v(C)
C.反应进行到6s时,B和D的物质的量浓度均为0.4molL﹣1
D.反应进行到6s时,B的平均反应速率为0.05mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其周期数相同;B的价电子排布式为nsnnpn+2;短周期元素C和D为同周期不相邻的元素,C是同周期元素中离子半径最小的元素,D元素最外层有两个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ECl4(氯化物)溶液的方法制备纳米材料。回答下列问题:
(1)D元素在周期表中的位置为__________________,E原子核外有_____个未成对电子,五种元素中电负性最大的是___________(填元素名称)。
(2)由A、B、D三种元素形成的常见三元化合物中具有强氧化性的是______(填化学式)。
(3)A、B、D元素形成的化合物有A2B、DB3,下列关于A2B和DB3的说法中,正确的是______(填标号)。
A.中心原子的价层电子对数目相等B.都是非极性分子C.中心原子的孤电子对数目相等D.都含有极性键E.都能与Na2O反应F.固态时晶体类型不同
(4)D在空气中燃烧的产物分子构型为______。固体DB3中存在如图(b)所示的三聚分子,该分子中D原子的杂化轨道类型为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在画某种原色的一种单核微粒的结构示意图时,忘记在圆圈内标出其核电荷数,请你根据下面的提示做出自己的判断。
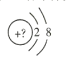
(1)若该微粒是电中性微粒,这种微粒的元素符号是_____________。
(2)若该微粒的还原性很弱,失去1个电子后变为原子,该原子的单质氧化性很强,该单质与水反应的 化学方程式为______________。
(3)若该微粒的氧化性很弱,得到1个电子后变为原子,该原子的单质还原性很强,该单质在氧气中燃烧所得产物的化学式为_______________。
(4)若该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式为_____________。
(5)若该微粒的符号为X3+,其氢氧化物与强碱反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的值,下列说法正确的是
A. 常温下,1L pH=13的Ba(OH)2溶液中OH-数为0.2NA
B. 2.4g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C. 氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA
D. 0.lmol/L(NH4)2SO4溶液与0.2mol/LNH4Cl溶液中的NH4+数目相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com