
【题目】对于2SO2(g)+O2(g)![]() 2SO3(g) △H<0的反应,下列装置示意图中的实验不能达到目的是( )
2SO3(g) △H<0的反应,下列装置示意图中的实验不能达到目的是( )
A. 研究压强对反应的影响(p2>p1)
研究压强对反应的影响(p2>p1)
B. 研究温度对反应的影响
研究温度对反应的影响
C. 研究平衡体系中增加O2浓度对反应的影响
研究平衡体系中增加O2浓度对反应的影响
D. 体积恒定的密闭容器中催化剂对反应的影响
体积恒定的密闭容器中催化剂对反应的影响
科目:高中化学 来源: 题型:
【题目】某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
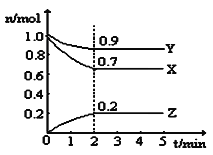
(1)该反应的化学方程式为______。
(2)反应开始至2min,以气体Z表示的平均反应速率为______。平衡时X的转化率为______。
(3)2min反应达到平衡,容器内混合气体的平均相对分子质量比起始时______![]() 填“大”、“小”或“相等”,下同
填“大”、“小”或“相等”,下同![]() ,混合气体密度比起始时______。
,混合气体密度比起始时______。
(4)下列叙述能证明该反应已经达到化学平衡状态的是![]() 填序号
填序号![]() ______。
______。
A.Y的体积分数不再变化 B.容器内气体压强不再变化
C.υ(X) :υ(Y) =3:1 D.单位时间内消耗3nmol X同时生成2nmol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将淀粉水解并用新制Cu(OH)2悬浊液检验水解产物的实验中,要进行的主要操作有:①加热;②滴入稀硫酸;③加入新制的Cu(OH)2悬浊液;④加入NaOH溶液中和。以上各步操作的先后顺序排列正确的是________。
A.②③④① B.②④③① C.②①④③ D.④③②①
(2)若某学生称取9g淀粉溶于水,按以下步骤做淀粉水解实验,回答下列问题。

①写出淀粉水解的化学方程式:________________。
②沉淀的单质是________________(写化学式)。
③填写所加试剂名称及其作用:
A________,作用________________________________;
B________,作用________________________________。
④当析出3.24g单质沉淀时,淀粉的水解率为________(已知1mol醛基发生银镜反应时生成2molAg)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液导电能力越强,电导率越大。常温下用0.1000 mol/L盐酸分别滴定10.00 mL浓度均为0.1000 mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,已知在常温下Kb[(CH3)2NH·H2O]=1.6×10-4),利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
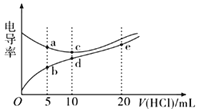
A.盐酸滴定二甲胺实验中选择酚酞做指示剂比选甲基橙误差更小
B.d点溶液中:c(H+)<c(OH-)+c[(CH3)2NH2+]
C.a点溶液与d点的溶液混合后的溶液中:c[(CH3)2NH2+]<c[(CH3)2NH·H2O]
D.b、c、e三点的溶液中,水的电离程度最大的是e点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3 的原理________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
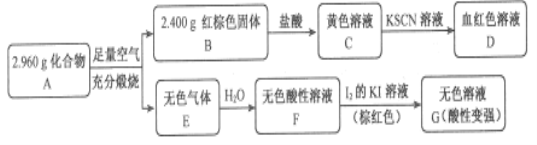
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),写出该反应的离子方程式_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种无色有刺激性气味的液体,在生活中有重要用途,同时也是一种重要的化工原料。
(1)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气、KOH溶液(电解质溶液)构成,则下列说法正确的是___。
(已知甲醇在空气中燃烧生成CO2和H2O)
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-=CO2↑+2H2O
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2mol电子
(2)写出甲醇燃料电池在酸性条件下负极的电极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题的填空:
(1)葡萄糖分子式_____。葡萄糖的检验方法有:A、在碱性、加热的条件下,与银氨溶液反应析出银。该反应被称为葡萄糖的银镜反应。B、在碱性、加热的的条件下,与新制氢氧化铜反应产生现象为___。
(2)能使蛋白质发生变性有重金属盐、甲醛(福尔马林溶液)、强酸强碱、紫外线、加热等,误食重金属离子后应喝大量___解毒。
(3)青霉素是重要的抗生素即消炎药,在使用之前要进行_________________,以防 止过敏反应的发生。维生素C又称抗坏血酸,是一种水溶性维生素,具有酸性和还原性,广泛存在于 ___________。
(4)碘是人体必需的微量元素,有“智力元素”之称。缺碘会造成________,补碘过量会造成甲状腺功能亢进。在食物中,海带、海鱼等海产品中含碘最多。加碘盐中添加的是 _____(填化学式)。
(5)铁是人体中必需微量元素中含量最多的一种。缺铁会发生____含铁较多的食物有动物内脏、动物全血、肉类、鱼类、蛋类等。
(6)羊毛、蚕丝属于蛋白质。检验蛋白质的简单方法:_________。
(7)某蛋白质分子中含铁0.28%,测知该分子的相对分子质量为20000。则该分子中含铁原子___个。(已知铁的相对原子质量为56)。
(8)将标准状况下5.6L HCl气体通入50ml水中充分吸收,然后加水冲稀至500ml,此时盐酸的物质的量浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可充电氟镁动力电池比锂电池具有更高的能量密度和安全性,在充电和放电时,其电池反应为Mg+2MnF3![]() 2MnF2+MgF2。下列说法不正确的是( )
2MnF2+MgF2。下列说法不正确的是( )
A. 放电时,镁为负极材料
B. 放电时,电子从镁极流出,经电解质流向正极
C. 充电时,阳极的电极反应式为:MnF2+F--e-=MnF3
D. 充电时,外加直流电源负极应与原电池的Mg极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种具有茉莉花香味的无色油状液体,结构简式是![]() ,其合成路线如下(部分反应条件未注明):
,其合成路线如下(部分反应条件未注明):

(1)烃A的结构简式是________________,C所含官能团的名称是_____________。
(2)为检验F中的官能团,可选用的试剂是____________________。
(3)E→F反应的化学方程式是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com