
【题目】下列描述中正确的是
①CS2为V形的极性分子
②ClO3-的空间构型为平面三角形
③SF6中有6对完全相同的成键电子对
④SiF4和SO32-的中心原子均为sp3杂化
A.①②B.②③C.③④D.①④
【答案】C
【解析】
①CS2中价层电子对数=2+![]() =2,且该分子中正负电荷重心重合,所以为直线形非极性分子,①错误;
=2,且该分子中正负电荷重心重合,所以为直线形非极性分子,①错误;
②ClO3-中Cl的价层电子对数=3+![]() =4,所以空间构型为三角锥形,②错误;
=4,所以空间构型为三角锥形,②错误;
③SF6中S-F含有一个成键电子对,所以SF6中含有6个S-F键,则分子中有6对完全相同的成键电子对,③正确;
④SiF4中价层电子对个数=4+![]() =4,SO32-中价层电子对个数=3+
=4,SO32-中价层电子对个数=3+![]() =4,因此中心原子均为sp3杂化,④正确,
=4,因此中心原子均为sp3杂化,④正确,
故选C。
【点晴】
根据价层电子对互斥理论确定微粒的空间构型及原子是杂化方式,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=(a-xb)/2,a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,答题时注意灵活应用。


科目:高中化学 来源: 题型:
【题目】按要求答题
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是________
(2)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:
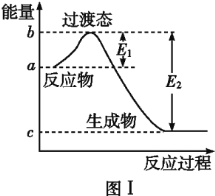
①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。NO2和CO反应的热化学方程式为________。
②下表所示是部分化学键的键能参数:
化学键 | P—P | P—O |
|
|
键能/(kJ·mol-1) | a | b | C | x |
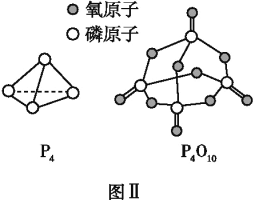
已知P4(g)+5O2(g)P4O10(g)ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=________(用含a、b、c、d的代数式表示)。
(3)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。燃烧时释放大量的热并快速产生大量气体。已知在101kPa、298K时,1mol液态N2H4在O2中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是________。
又知:H2O(g)=H2O(l)ΔH=-44kJ·mol-1,若1mol液态N2H4在O2中完全燃烧生成N2和液态水,则放出的热量为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乐山某高中化学兴趣小组同学用西红柿(或洋葱)作为供水剂,设计了如图装置验证铁与水蒸气的反应,并对产物进行检验。回答下列问题:
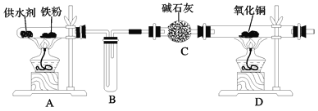
(1)A中铁与水蒸气反应的化学方程式是__。
(2)C中碱石灰的作用是__。
(3)D处实验现象为__。
(4)上述实验结束后,取出A中铁粉反应后的少量固体继续进行如下实验:
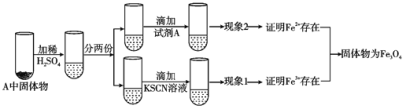
(Ⅰ)固体A中Fe3O4与稀硫酸反应的离子方程式为__。
(Ⅱ)试剂A是__(选填字母)。
a.NaOH溶液 b.酸性KMnO4溶液 c.酚酞 d.新制氯水
(Ⅲ)有同学认为;即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 的分子式均为C5H8O2,下列说法正确的是( )
的分子式均为C5H8O2,下列说法正确的是( )
A.x分子中碳原子均位于同一平面
B.x、y均能与NaOH溶液发生反应
C.y、z均能与![]() 反应生成
反应生成![]()
D.与它们互为同分异构体的链状羧酸有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物既是可导致酸雨的物质,也是造成空气污染的重要物质,加大对氮的氧化物的治理是环境保护重要举措。
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式: _____________________________,该反应中氧化剂是_________,还原剂是________________________________________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为___________________________________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收nmol NO2和mmol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为_________ mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=_________。
③用含n和m的代数式表示所得溶液中NO3-和NO2-浓度的比值c(NO3-)∶c(NO2-)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是![]()
A.金刚石、SiC、NaF、NaCl、![]() 、
、![]() 晶体的熔点依次降低
晶体的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,CaO晶体中![]() 的配位数为6,且这些最邻近的
的配位数为6,且这些最邻近的![]() 围成正八面体
围成正八面体
C.设NaCl的摩尔质量为![]() ,NaCl的密度为
,NaCl的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]()
![]() ,在NaCl晶体中,两个距离最近的
,在NaCl晶体中,两个距离最近的![]() 中心间的距离为
中心间的距离为
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的化学式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V 1 mL 0.1mol·L-1的Fe2(SO4)3溶液与2mL 0.1mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是( )
A.若V1<1,加入淀粉B.若V1≤1,加入KSCN溶液
C.若V1≥1,加入AgNO3溶液D.加入Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如右图所示。下列说法正确的是( )
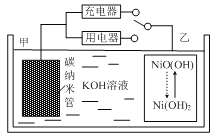
A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为Ni(OH)2+OH--e-=NiO(OH)+H2O
C.充电时,电池的甲电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如图所示:
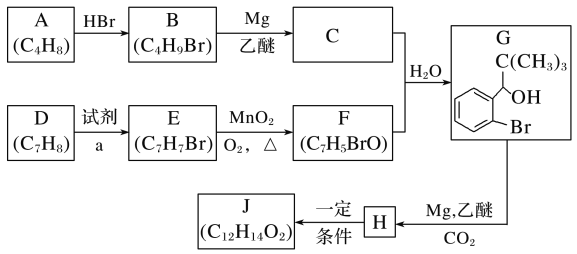
已知:
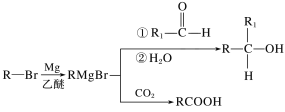
(1)B的化学名称是__,F中官能团名称是__。
(2)由E生成F的反应类型是__,由H生成J的反应类型是__。
(3)试剂a是__。
(4)J是一种环酯,则J的结构简式为__。H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为__。
(5)利用题中信息写出以乙醛和苯为原料,合成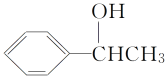 的流程图(其他试剂自选)___。
的流程图(其他试剂自选)___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com