
����Ŀ����Ҫ�����
��1��CuCl(s)��O2��Ӧ����CuCl2(s)��һ�ֺ�ɫ���塣��25����101kPa��,��֪�÷�Ӧÿ����1molCuCl(s),����44.4kJ,�÷�Ӧ���Ȼ�ѧ����ʽ��________
��2����֪E1=134kJ��mol-1��E2=368kJ��mol-1,��ο�����ͼ��,��Ҫ�����:
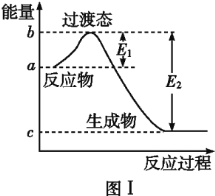
��ͼ����1molNO2(g)��1molCO(g)��Ӧ����CO2(g)��NO(g)�����е������仯ʾ��ͼ,���ڷ�Ӧ��ϵ�м������,��Ӧ���ʼӿ�,E1�ı仯��________(��������������С������������,��ͬ),��H�ı仯��________��NO2��CO��Ӧ���Ȼ�ѧ����ʽΪ________��
���±���ʾ�Dz��ֻ�ѧ���ļ��ܲ���:
��ѧ�� | P��P | P��O |
|
|
����/(kJ��mol-1) | a | b | C | x |
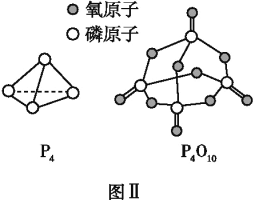
��֪P4(g)+5O2(g)P4O10(g)��H=��dkJ��mol-1,P4��P4O10�Ľṹ��ͼ����ʾ������x=________(�ú�a��b��c��d�Ĵ���ʽ��ʾ)��
��3����(N2H4)��һ�ֿ�ȼ�Ե�Һ��,���������ȼ�ϡ�ȼ��ʱ�ͷŴ������Ȳ����ٲ����������塣��֪��101kPa��298Kʱ,1molҺ̬N2H4��O2����ȫȼ������N2��ˮ����,�ų�����624kJ,�÷�Ӧ���Ȼ�ѧ����ʽ��________��
��֪:H2O(g)=H2O(l)��H=��44kJ��mol-1,��1molҺ̬N2H4��O2����ȫȼ������N2��Һ̬ˮ,��ų�������Ϊ________kJ��
���𰸡�4CuCl(s)+O2(g)2CuCl2(s)+2CuO(s)��H=��177.6kJ��mol-1 ��С ���� NO2(g)+CO(g)CO2(g)+NO(g)��H=��234kJ��mol-1 ![]() N2H4(l)+O2(g)N2(g)+2H2O(g)��H=��624kJ��mol-1 712
N2H4(l)+O2(g)N2(g)+2H2O(g)��H=��624kJ��mol-1 712
��������
(1)CuCl(s)��O2��Ӧ����CuCl2(s)��CuO�����������֪��ÿ����1mol CuCl(s)����Ӧ����44.4kJ����4molCuCl��Ӧ�ų�����Q=44.4kJ��4=177.6kJ����÷�Ӧ���Ȼ�ѧ����ʽΪ4CuCl (s)+O2(g)=2CuCl2(s)+2CuO(s) ��H=-177.6 kJ/mol���ʴ�Ϊ��4CuCl(s)+O2(g)2CuCl2(s)+2CuO(s)��H=��177.6kJ��mol-1��
(2)�ټ�������ܽ��ͷ�Ӧ����Ļ�ܣ���E1��E2����С���������ܸı䷴Ӧ������������������������֮�����Ӧ�Ȳ��䣬���Դ����Է�Ӧ����Ӱ�죬��ͼ��֪��1mol NO2��1mol CO��Ӧ����CO2��NO�ų�����368-134=234kJ����Ӧ�Ȼ�ѧ����ʽΪNO2(g)��CO(g)===CO2(g)��NO(g) ��H����234 kJ��mol��1���ʴ�Ϊ����С�����䣻NO2(g)��CO(g)===CO2(g)��NO(g) ��H����234 kJ��mol��1��
�ڰ���ȼ�յķ���ʽΪP4+5O2=P4O10��1mol������ȫȼ�������6mol P-P��5mol O=O���γ�12molP-O��4mol P=O������12mol��b kJ/mol+4mol��x kJ/mol-��6mol��a kJ/mol+5 mol��c kJ/mol��=d kJ/mol��x=![]() kJ/mol���ʴ�Ϊ��
kJ/mol���ʴ�Ϊ��![]() ��
��
(3)��101kPa��25��ʱ��ʱ����֪1molҺ̬��������������Ӧ�����ɵ�����ˮ�������ų�624KJ����������÷�Ӧ���Ȼ�ѧ����ʽΪ��N2H4��1��+O2��g��=N2��g��+2H2O��g����H=-624kJ/mol���������Һ̬ˮ��1mol����ȫ��Ӧ�ų�������Ϊ��624kJ+44��2kJ=712kJ���ʴ�ΪN2H4��l��+O2��g��=N2��g��+2H2O��g����H=-624KJ/mol��712��


 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��Ԫ�����ڱ��е�λ����ͼ��ʾ������˵������ȷ����( )
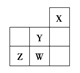
A. Y��ԭ�Ӱ뾶��ͬ��������Ԫ�������
B. W�ķǽ����Ա�Z����
C. Z����̬�⻯����ȶ�����ͬ����Ԫ������ǿ
D. W������������Ӧ��ˮ������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���Na+��NH4+��SO42-��SO32-��Cl-��Fe2+��Fe3+��CO32-�е������֣��Ҹ�����Ũ�Ⱦ���ͬ��Ϊȷ��������ֽ�������ʵ�飺
������Һ�м������������ữ��Ba(NO3)2��Һ��������ɫ����������
������е���Һ��������NaOH��Һ���г������ɣ��ȣ����������
����˵����ȷ����( )
A.��ȷ��ԭ��Һ���Ƿ����SO32-
B.�Ƿ����![]() ��Ҫͨ����ɫ��Ӧ��ȷ��
��Ҫͨ����ɫ��Ӧ��ȷ��
C.CO32-�϶������ڣ�Fe2+��Fe3+������һ��
D.��Һ�д���NH4+��SO42-��Cl-��Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ݻ�ΪV mL�ļ���ƿ���ռ����������ڿ�����δ�ž������ƿ������������������ܶ�Ϊ9.5������ʢ������ļ���ƿ������ˮ�У�ƿ��ˮ��������һ���߶Ⱥ�ֹͣ����������ͬ��ͬѹ�£�ƿ��ʣ����������Ϊ�� ��
A.![]() mLB.
mLB.![]() mLC.
mLC.![]() mLD.���ж�
mLD.���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��ı�0.1 molL-1��Ԫ����H2A��Һ��pH����Һ�е�H2A��HA-��A2-�����ʵ�������![]() (X)��pH�ı仯��ͼ��ʾ[��֪]
(X)��pH�ı仯��ͼ��ʾ[��֪]![]() (X)=
(X)=![]() ����������������ǣ� ��
����������������ǣ� ��
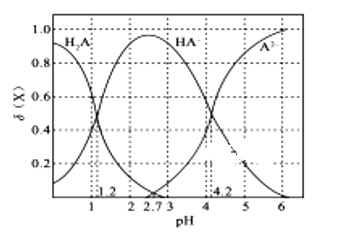
A.pH=1.2ʱ, c(K+)+c(H+)=c(H2A) + c(OH-)+2c(A2��)
B.�����£�H2A�ĵ���ƽ�ⳣ��Ka2 =10-4.2
C.pH=2.7ʱ��c(HA-)��c(H2A)=c(A2-)
D.KHA��Һ������Ũ��Ϊc(K+)��c(HA-)��c(OH-)��c(H2A)��c(H+)��c(A2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ǻ�ѧ�о��Ļ������������и�ʵ��װ��ͼ��������ȷ����( )
|
|
|
|
�� | �� | �� | �� |
A.װ�â�����Һ�ϲ���ɫ���²��Ϻ�ɫB.װ�âڿ���������HCl���壬����ֹ����
C.װ�âۿ�������ȡ����ˮD.װ�â���Һ�����ɺ�ֹͣ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ����Ũ�����ڼ��������·�Ӧ����Ӧ����ʽΪ��
_____Cu +____H2SO4��Ũ�� ![]() _____CuSO4 +____SO2��+_____H2O
_____CuSO4 +____SO2��+_____H2O
(1)��ƽ��������ʽ������˫���ŷ���������ת�Ƶķ������Ŀ___________���ڴ�����ϵķ���ʽ�б�ʾ����
(2)�÷�Ӧ�л�ԭ��Ϊ___________����������Ϊ__________��
(3)�÷�Ӧ��ŨH2SO4����____________�ԣ�
(4)��ԭ���������������ʵ���֮��Ϊ______�������������SO2�����Ϊ11.2 L����Ӧʱת�Ƶĵ���Ϊ_______ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ�������[Fe(OH)SO4]n��������ˮ��(������)�������̷�(FeSO47H2O)��KClO3��ˮ��Һ�з�Ӧ�õ�������˵������ȷ���ǣ� ��
A.KClO3����������ÿ����1mol[Fe(OH)SO4]n����![]() molKClO3
molKClO3
B.���ɾۺ���������ˮ��Һ��pH����
C.�ۺ�����������ˮ��Һ��ˮ���������������������ˮ
D.�ڷ�Ӧ���������ͻ�ԭ�����ʵ���֮��Ϊ1��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
��CS2ΪV�εļ��Է���
��ClO3���Ŀռ乹��Ϊƽ��������
��SF6����6����ȫ��ͬ�ijɼ����Ӷ�
��SiF4��SO32��������ԭ�Ӿ�Ϊsp3�ӻ�
A.�٢�B.�ڢ�C.�ۢ�D.�٢�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com