
【题目】某溶液中可能含有Na+、NH4+、SO42-、SO32-、Cl-、Fe2+、Fe3+、CO32-中的若干种,且各离子浓度均相同。为确定其组成现进行如下实验:
①向溶液中加入足量硝酸酸化的Ba(NO3)2溶液,产生白色沉淀,过滤
②向①中的滤液加入足量NaOH溶液,有沉淀生成,微热,有气体产生
下列说法正确的是( )
A.无法确定原溶液中是否存在SO32-
B.是否存在![]() 需要通过焰色反应来确定
需要通过焰色反应来确定
C.CO32-肯定不存在,Fe2+、Fe3+至少有一种
D.溶液中存在NH4+、SO42-、Cl-、Fe2+
【答案】D
【解析】
①向溶液中加入足量硝酸酸化的Ba(NO3)2溶液,产生白色沉淀,说明沉淀不溶于硝酸,沉淀为BaSO4,由于硝酸具有强氧化性能将亚硫酸钡氧化为硫酸钡,所以原溶液中存在SO42-、SO32-中的一种或两种;
②在①中加入了足量的硝酸,滤液中不存在CO32-,不能确定原溶液中是否含有CO32-;向①中的滤液加入足量NaOH溶液,有沉淀生成,此沉淀为Fe(OH)3,由于硝酸能将Fe2+氧化为Fe3+,所以不能确定Fe(OH)3中Fe3+的来源,原溶液中可能含有Fe2+、Fe3+中至少一种;微热,有气体产生,此气体为NH3,说明原溶液中含有NH4+;
③由②分析原溶液中含有NH4+,至少含有Fe2+、Fe3+中的一种,由于和SO32-、CO32-发生反应,所以原溶液中一定无SO32-、CO32-,则有SO42-。
A.由上分析,原溶液中不存在SO32-,A错误;
B.由上分析,原溶液中一定存在NH4+、SO42-,根据各离子浓度均相同及电荷守恒可知溶液中还存在Fe2+、Cl-,不存在Na+,B错误;
C.由上分析,CO32-肯定不存在,存在Fe2+,不存在Fe3+,C错误;
D.由上分析,结合B选项,溶液中存在NH4+、SO42-、Cl-、Fe2+,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g)2Z(g),其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.改变压强,平衡常数不变,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 H2O 和 H2S 的说法正确的是
A.H2O 比 H2S 稳定,是因为 H2O 分子间有氢键,而 H2S 分子间只有范德华力
B.二者中心原子杂化方式均为 sp2 杂化
C.H2S 的水溶液呈酸性,而 H2O 成中性,说明 O 元素的非金属性强于 S 元素
D.键角 H2O 大于 H2S,是因为氧的电负性大于硫,两个 O-H 键之间的排斥力大于两个 S-H 键的排斥力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1)
2NH3(g) ΔH=-92.4kJ·mol-1)

下列说法正确的是( )
A.2c1>c3B.a+b=92.4C.2p1<p3D.α1+α3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态 K 原子中,核外电子占据的最高能层的符号是_____,占据该能层电子的电子云轮廓图形状为_____。K 和 Cr 属于同一周期,且核外最外层电子构型相同,但金属 K 的熔 点、沸点等都比金属 Cr 低,原因是_____。
(2)X 射线衍射测定等发现,I3AsF6 中存在 I3+ 离子。I3+ 离子的几何构型为____________,中心原子的杂化类型为_______________ 。
(3)KIO3 晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结 构,边长为 a=0.446nm,晶胞中 K、I、O 分别处于顶角、体心、面心位置, 如图所示。K 与 O 间的最短距离为_____nm,与 K 紧邻的 O 个数为_____。
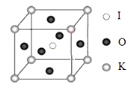
(4)在 KIO3 晶胞结构的另一种表示中,I 处于各顶角位置,则 K 处于_____________位置,O 处于_____位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纸电池是一种有广泛应用的“软电池”,右图这种碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰。下列有关该纸电池说法不合理的是

A.Zn为负极,进行氧化反应
B.电池工作时,电子由MnO2流向Zn
C.正极反应:MnO2+e-+H2O=MnO(OH)+OH-
D.电池总反应:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
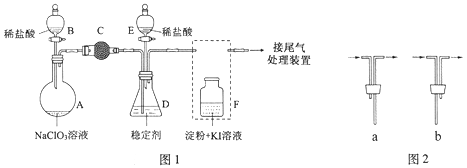
(1)仪器D的名称是 。安装F中导管时,应选用图2中的 。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 ,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。
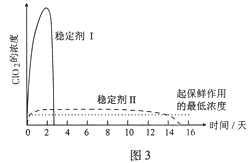
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 ,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是________
(2)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:
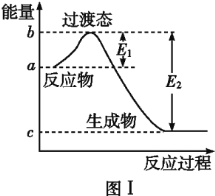
①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。NO2和CO反应的热化学方程式为________。
②下表所示是部分化学键的键能参数:
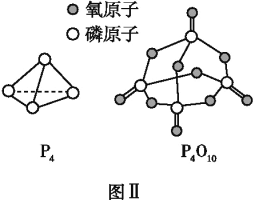
化学键 | P—P | P—O |
|
|
键能/(kJ·mol-1) | a | b | C | x |
已知P4(g)+5O2(g)P4O10(g)ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=________(用含a、b、c、d的代数式表示)。
(3)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。燃烧时释放大量的热并快速产生大量气体。已知在101kPa、298K时,1mol液态N2H4在O2中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是________。
又知:H2O(g)=H2O(l)ΔH=-44kJ·mol-1,若1mol液态N2H4在O2中完全燃烧生成N2和液态水,则放出的热量为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乐山某高中化学兴趣小组同学用西红柿(或洋葱)作为供水剂,设计了如图装置验证铁与水蒸气的反应,并对产物进行检验。回答下列问题:
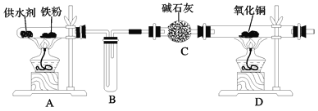
(1)A中铁与水蒸气反应的化学方程式是__。
(2)C中碱石灰的作用是__。
(3)D处实验现象为__。
(4)上述实验结束后,取出A中铁粉反应后的少量固体继续进行如下实验:
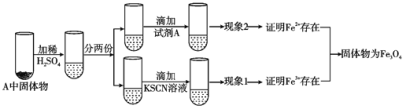
(Ⅰ)固体A中Fe3O4与稀硫酸反应的离子方程式为__。
(Ⅱ)试剂A是__(选填字母)。
a.NaOH溶液 b.酸性KMnO4溶液 c.酚酞 d.新制氯水
(Ⅲ)有同学认为;即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com