
【题目】下列关于 H2O 和 H2S 的说法正确的是
A.H2O 比 H2S 稳定,是因为 H2O 分子间有氢键,而 H2S 分子间只有范德华力
B.二者中心原子杂化方式均为 sp2 杂化
C.H2S 的水溶液呈酸性,而 H2O 成中性,说明 O 元素的非金属性强于 S 元素
D.键角 H2O 大于 H2S,是因为氧的电负性大于硫,两个 O-H 键之间的排斥力大于两个 S-H 键的排斥力
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,其原子半径的大小顺序为X>Y>Z,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的反应,其中A为X、Y组成的双原子分子,B和C均为10电子分子。下列判断错误的是( )
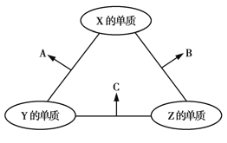
A.X的最外层电子数为6
B.A和C之间不可能发生氧化还原反应
C.B的沸点高于C的沸点
D.A不能溶于B中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
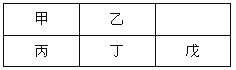
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示。下列说法中正确的是( )
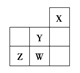
A. Y的原子半径在同周期主族元素中最大
B. W的非金属性比Z的弱
C. Z的气态氢化物的稳定性在同主族元素中最强
D. W的最高价氧化物对应的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )

A. 图Ⅰ研究的是t0时升高温度对反应速率的影响
B. 图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。下列说法不正确的是
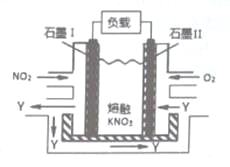
A.NO2在石墨I附近发生氧化反应
B.该电池放电时N03-向石墨I电极迁移
C.石墨Ⅱ附近发生的反应:O2+4e-+2N205=4N03-
D.相同条件下,放电过程中消耗的NO2和O2的体积比为l:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、NH4+、SO42-、SO32-、Cl-、Fe2+、Fe3+、CO32-中的若干种,且各离子浓度均相同。为确定其组成现进行如下实验:
①向溶液中加入足量硝酸酸化的Ba(NO3)2溶液,产生白色沉淀,过滤
②向①中的滤液加入足量NaOH溶液,有沉淀生成,微热,有气体产生
下列说法正确的是( )
A.无法确定原溶液中是否存在SO32-
B.是否存在![]() 需要通过焰色反应来确定
需要通过焰色反应来确定
C.CO32-肯定不存在,Fe2+、Fe3+至少有一种
D.溶液中存在NH4+、SO42-、Cl-、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜能与浓硫酸在加热条件下反应,反应方程式为:
_____Cu +____H2SO4(浓) ![]() _____CuSO4 +____SO2↑+_____H2O
_____CuSO4 +____SO2↑+_____H2O
(1)配平上述方程式,并用双线桥法分析电子转移的方向和数目___________(在答题卷上的方程式中表示);
(2)该反应中还原剂为___________,氧化产物为__________;
(3)该反应中浓H2SO4体现____________性;
(4)还原剂与氧化剂的物质的量之比为______,标况下若生成SO2的体积为11.2 L,则反应时转移的电子为_______ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com