
【题目】铜能与浓硫酸在加热条件下反应,反应方程式为:
_____Cu +____H2SO4(浓) ![]() _____CuSO4 +____SO2↑+_____H2O
_____CuSO4 +____SO2↑+_____H2O
(1)配平上述方程式,并用双线桥法分析电子转移的方向和数目___________(在答题卷上的方程式中表示);
(2)该反应中还原剂为___________,氧化产物为__________;
(3)该反应中浓H2SO4体现____________性;
(4)还原剂与氧化剂的物质的量之比为______,标况下若生成SO2的体积为11.2 L,则反应时转移的电子为_______ mol。
【答案】1 2 1 2 2 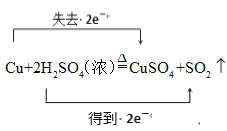 +2H2O Cu CuSO4 酸性和氧化性 1:1 1mol
+2H2O Cu CuSO4 酸性和氧化性 1:1 1mol
【解析】
结合元素化合价的变化,根据氧化还原反应的理论分析解答即可。
(1)在 Cu+H2SO4(浓)![]() CuSO4+SO2↑+H2O中Cu元素化合价从0价升高为+2价,S元素从+6价降为+4价,结合电子守恒和原子守恒即可配平得到Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O中Cu元素化合价从0价升高为+2价,S元素从+6价降为+4价,结合电子守恒和原子守恒即可配平得到Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,用双线桥法分析电子转移的方向和数目为
CuSO4+SO2↑+2H2O,用双线桥法分析电子转移的方向和数目为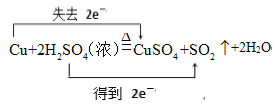 ;
;
(2)该反应中Cu元素化合价升高,发生氧化反应,则还原剂为Cu,氧化产物为CuSO4;
(3)该反应中部分S元素从+6价降为+4价,即部分硫酸作氧化剂,则浓H2SO4体现酸性和氧化性;
(4)参加反应的硫酸物质的量的![]() 作氧化剂,则还原剂与氧化剂的物质的量之比为1:1,反应中S元素从+6价降为+4价,标况下11.2 L SO2的物质的量为
作氧化剂,则还原剂与氧化剂的物质的量之比为1:1,反应中S元素从+6价降为+4价,标况下11.2 L SO2的物质的量为![]() =0.5mol,则反应时转移的电子物质的量为0.5mol×2=1mol。
=0.5mol,则反应时转移的电子物质的量为0.5mol×2=1mol。


科目:高中化学 来源: 题型:
【题目】下列关于 H2O 和 H2S 的说法正确的是
A.H2O 比 H2S 稳定,是因为 H2O 分子间有氢键,而 H2S 分子间只有范德华力
B.二者中心原子杂化方式均为 sp2 杂化
C.H2S 的水溶液呈酸性,而 H2O 成中性,说明 O 元素的非金属性强于 S 元素
D.键角 H2O 大于 H2S,是因为氧的电负性大于硫,两个 O-H 键之间的排斥力大于两个 S-H 键的排斥力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
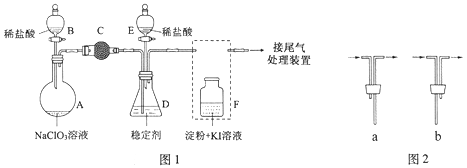
(1)仪器D的名称是 。安装F中导管时,应选用图2中的 。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 ,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。
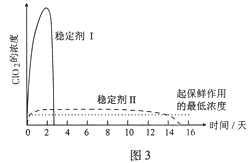
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 ,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是________
(2)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:
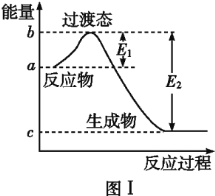
①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。NO2和CO反应的热化学方程式为________。
②下表所示是部分化学键的键能参数:
化学键 | P—P | P—O |
|
|
键能/(kJ·mol-1) | a | b | C | x |
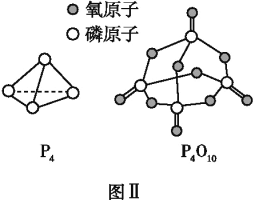
已知P4(g)+5O2(g)P4O10(g)ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=________(用含a、b、c、d的代数式表示)。
(3)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。燃烧时释放大量的热并快速产生大量气体。已知在101kPa、298K时,1mol液态N2H4在O2中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是________。
又知:H2O(g)=H2O(l)ΔH=-44kJ·mol-1,若1mol液态N2H4在O2中完全燃烧生成N2和液态水,则放出的热量为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
(1)在原子经济学原则引导下,化学家用CO与H2在加热加压条件合成了液体燃料甲醇,其化学反应方程式___。
(2)以甲醇做燃料的电池,如图所示,其负极是___(填a或b),负极的反应式为___,正极的反应式为___。该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将64gCu与一定浓度的HNO3反应,Cu全部反应完后,收集到标准状况下NO和NO2混合气体22.4L。请回答下列问题:
(1)Cu与HNO3反应生成NO的离子方程式为____________________。该反应体现的HNO3的性质为______(填字母)。
A.强氧化性 B.酸性 C.不稳定性 D.易挥发性
(2)参加反应的Cu转移电子的数目为______。
(3)该反应中消耗HNO3的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
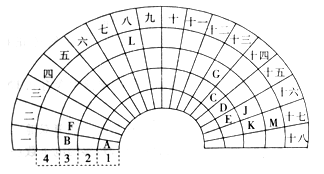
(1)元素C的最高价氧化物的电子式为____;元素G的离子结构示意图为____。
(2)元素L位于周期表的第_________族,1mol/L LM2溶液500mL与0.4 mol K单质恰好完全反应的离子方程式为_______________________________________。
(3)化合物X是由B、E、G三种元素组成,其水溶液呈_____性,原因是____________(用离子方程式表示)。
(4)D和G组成的化合物GD,被大量用于制造电子元件。工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的物质的量之比为1:3,则该反应的化学方程式为___________。
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乐山某高中化学兴趣小组同学用西红柿(或洋葱)作为供水剂,设计了如图装置验证铁与水蒸气的反应,并对产物进行检验。回答下列问题:
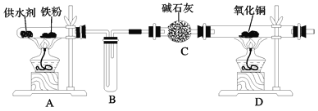
(1)A中铁与水蒸气反应的化学方程式是__。
(2)C中碱石灰的作用是__。
(3)D处实验现象为__。
(4)上述实验结束后,取出A中铁粉反应后的少量固体继续进行如下实验:
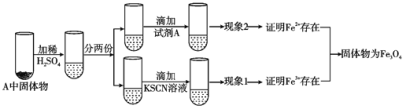
(Ⅰ)固体A中Fe3O4与稀硫酸反应的离子方程式为__。
(Ⅱ)试剂A是__(选填字母)。
a.NaOH溶液 b.酸性KMnO4溶液 c.酚酞 d.新制氯水
(Ⅲ)有同学认为;即使得到了现象1和现象2的实验现象,也不能确定所得固体成分为Fe3O4。你认为该同学持此看法的理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V 1 mL 0.1mol·L-1的Fe2(SO4)3溶液与2mL 0.1mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是( )
A.若V1<1,加入淀粉B.若V1≤1,加入KSCN溶液
C.若V1≥1,加入AgNO3溶液D.加入Ba(NO3)2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com