
【题目】减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
(1)在原子经济学原则引导下,化学家用CO与H2在加热加压条件合成了液体燃料甲醇,其化学反应方程式___。
(2)以甲醇做燃料的电池,如图所示,其负极是___(填a或b),负极的反应式为___,正极的反应式为___。该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为___。

【答案】CO+2H2![]() CH3OH b CH3OH﹣6e﹣+H2O=CO2+6H+ O2+4e﹣+4H+═2H2O CH3OH(l)+
CH3OH b CH3OH﹣6e﹣+H2O=CO2+6H+ O2+4e﹣+4H+═2H2O CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=﹣727.6kJ/mol
O2(g)=CO2(g)+2H2O(l)△H=﹣727.6kJ/mol
【解析】
(1)根据CO与H2在加热加压条件合成了液体燃料甲醇,其化学反应方程式:CO+2H2![]() CH3OH;
CH3OH;
(2)燃料电池中通入燃料的一极为负极,故b是负极,a是正极;负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,该燃料电池的电解质溶液呈酸性,所以负极上甲醇失电子和水反应生成二氧化碳和氢离子,负极反应式为CH3OH-6e-+H2O=CO2+6H+,氧气在正极上生成水,正极电极反应式为:O2+4e-+4H+═2H2O;
96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,燃烧1mol液体甲醇放出热量为702.1kJ÷96.5%=727.6kJ,其热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=﹣727.6kJ·mol-1。
O2(g)=CO2(g)+2H2O(l)△H=﹣727.6kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列分析中不正确的是( )

A. 图Ⅰ研究的是t0时升高温度对反应速率的影响
B. 图Ⅱ研究的是t0时增大压强(缩小容积)或使用催化剂对反应速率的影响
C. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
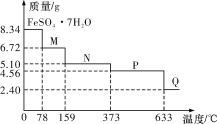
A.温度为78 ℃时固体物质M的化学式为FeSO4·5H2O
B.温度为159 ℃时固体N的化学式为FeSO4·2H2O
C.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时只得到一种无色气体生成
D.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,改变0.1 molL-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() (X)随pH的变化如图所示[已知]
(X)随pH的变化如图所示[已知]![]() (X)=
(X)=![]() 。下列叙述错误的是( )
。下列叙述错误的是( )
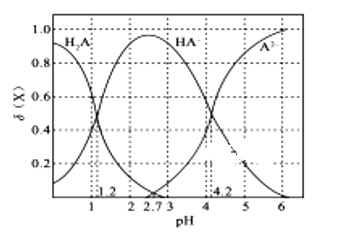
A.pH=1.2时, c(K+)+c(H+)=c(H2A) + c(OH-)+2c(A2-)
B.常温下,H2A的电离平衡常数Ka2 =10-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.KHA溶液中粒子浓度为c(K+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图装置进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )
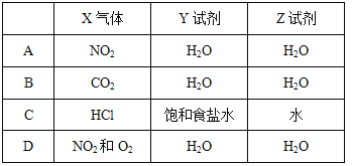
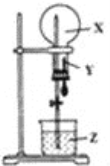
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜能与浓硫酸在加热条件下反应,反应方程式为:
_____Cu +____H2SO4(浓) ![]() _____CuSO4 +____SO2↑+_____H2O
_____CuSO4 +____SO2↑+_____H2O
(1)配平上述方程式,并用双线桥法分析电子转移的方向和数目___________(在答题卷上的方程式中表示);
(2)该反应中还原剂为___________,氧化产物为__________;
(3)该反应中浓H2SO4体现____________性;
(4)还原剂与氧化剂的物质的量之比为______,标况下若生成SO2的体积为11.2 L,则反应时转移的电子为_______ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl为白色粉末,微溶于水,不溶于乙醇,潮湿的CuCl在空气中被氧化为Cu2(OH)3Cl。
(1)一种由海绵铜(Cu)为原料制备CuCl的工艺流程如下:

①“溶解”步骤发生反应的离子方程式为_________________________________;
②潮湿的CuCl在空气中被氧化的化学反应方程式为_________________________________;
③已知常温下Cu(OH)2溶度积常数Ksp=2×10-20要使c(Cu2+)=0.2 mol·L-1的硫酸铜溶液中的铜离子沉淀比较完全(使铜离子浓度变为原来的千分之一)则应调节溶液pH为___________以上。
(2)次磷酸(H3PO2)是一元中强酸,可用于作金属表面处理剂。
①向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的化学方程式:_____________;
②H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。在该过程中,氧化剂与还原剂的物质的量之比为:___________;
③NaH2PO2的水溶液呈弱碱性,用离子方程式说明原因:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:

下列有关判断不正确的是
A.甲的分子式为 C6H12
B.乙与环己二烯互为同系物
C.上述流程发生的反应类型有取代反应、消去反应、加成反应
D.环己二烯与溴水 1:1 反应可得 2 种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26届会议修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),于2019年5月2日正式生效。设NA是阿伏加德罗常数的值,下列说法正确的是
A.40g正丁烷和18 g异丁烷的混合物中共价键数目为13NA
B.常温常压下,124 g P4中所含P—P键数目为4NA
C.电解精炼铜时,阳极质量减小3.2g时,转移的电子数为0.1NA
D.0.1mol FeCl3完全水解转化为氢氧化铁胶体,生成胶粒数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com